附件1:
化妆品安全风险评估指南
(征求意见稿)
目 录
1. 适用范围. 1
2. 基本原则与要求. 1
3. 化妆品安全风险评估人员的要求. 2
4. 风险评估程序. 2
5. 毒理学研究. 9
6. 化妆品原料的风险评估. 12
7. 化妆品产品的安全评价. 17
8. 安全风险评估报告. 21
9. 术语和释义. 21
化妆品安全风险评估指南
为保证消费者的健康安全,识别和控制化妆品安全风险,制定本指南。
1. 适用范围
适用于化妆品原料的风险评估和产品的安全评价,包括由原料或产品生产过程中不可避免带入的安全性风险物质的风险评估。
2. 基本原则与要求
2.1化妆品一般可认为是各种原料的组合,原料的安全性是化妆品安全的前提条件。化妆品的安全性评价应基于所有原料和风险物质的风险评估。如果确认某些原料之间存在化学、生物学等相互作用的,应该对其产生的风险物质进行评估。
2.2化妆品安全性评价应以现有科学数据和相关信息为基础,遵循科学、公正、透明和个案处理的原则,在实施过程中应保证风险评估工作的独立性。
2.3化妆品的安全风险评估工作由具有相应资质的安全风险评估人员按照本指南的要求进行评价,并出具风险评估报告。
2.4化妆品产品的安全风险评估资料应当及时更新,并保留至最后一批上市产品保质期结束以后10年。
2.5化妆品安全风险评估报告结论不足以排除产品对人体健康存在风险的,应当采用传统毒理学试验方法进行产品安全性评价。
3.化妆品安全风险评估人员的要求
化妆品安全风险评估人员应符合以下要求:
3.1具有化妆品专业知识基础,了解化妆品生产过程和质量安全控制要求;
3.2能够查阅和分析毒理学信息,具有分析、评价和解释毒理学数据的能力;
3.3能够公平、客观的分析化妆品的安全性,在全面分析所有可获得的数据和暴露条件的基础上,开展风险评估工作;
3.4应当具有医学、药学、化学、毒理学或者类似学科的专业基础,取得大学本科以上文凭或其他正式资格证明,并具有5年以上相关专业从业经历。
3.5应当定期接受相应的专业培训。应当不断深入学习风险评估的知识,了解和掌握新的风险评估方法,掌握化妆品安全风险评估的信息。
4.风险评估程序
化妆品原料和风险物质的风险评估程序分为以下四个步骤:
4.1危害识别
基于毒理学试验、临床研究、不良反应监测、和人类流行病学研究的结果,从原料或风险物质的物理、化学和毒理学本质特征来确定其是否对人体健康存在潜在危害。
4.1.1 化妆品健康危害效应
主要包括:
(1)急性毒性:包括经口、经皮或吸入后产生的急性毒性效应。
(2)刺激性:包括皮肤刺激性和眼刺激性效应。
(3)致敏性:主要为皮肤致敏性。
(4)光毒性:包括紫外线照射后产生的光毒性和光敏性效应。
(5)致突变性:包括基因突变和染色体畸变效应等。
(6)慢性毒性:包括长期暴露后对组织和靶器官所产生的功能和/或器质性改变。
(7)发育和生殖毒性:包括引起胎儿发育畸形的改变等。
(8)致癌性:包括所发生肿瘤的类型、部位、发生率等。
4.1.2 危害识别
(1)危害识别主要根据原料或风险物质的毒理学试验结果来判定。按照我国现行的化妆品技术规范或国际上通用的毒理学试验结果的判定原则对化妆品原料和风险物质的急性毒性、皮肤刺激性/腐蚀性、急性眼刺激性/腐蚀性、致敏性、光毒性、致突变性、慢性毒性、发育和生殖毒性、致癌性等毒性特征进行判定,确定该原料或风险物质的主要毒性特征及程度。
(2)根据所提供的化妆品原料或风险物质的人群流行病学调查、人群监测以及临床不良事件报告等相关资料,判定该原料或风险物质可能对人体产生的危害效应;
(3)在对危害识别进行判定时,还应考虑到原料的纯度和稳定性、其可能与化妆品终产品中其它组分发生的反应、以及透皮吸收的能力等,同时还应考虑到原料中的杂质或生产过程中不可避免带入原料中的成分的毒性等。
(4)对于复合性原料,应对其中所有组分的危害效应进行识别。
4.2剂量反应关系评估
用于确定原料或风险物质的毒性反应与暴露剂量之间的关系。对阈值效应而言,需要进行未观察到有害作用的剂量(NOAEL)的测定,如果不能得到NOEAL,则采用其观察到有害作用的最低剂量(LOEAL)。对于无阈值致癌物而言,用剂量描述性来确定。
4.2.1有阈值原料的剂量反应关系评价,需确定原料的系统毒性未观察到有害作用的剂量(NOAEL)值。
当选择NOAEL计算安全系数时,应选择来自系统毒理学效应的、重复剂量毒性实验的数据,如亚慢性和/或慢性毒性试验、致癌试验、致畸试验、生殖/发育毒性试验等。
在选择NOAEL值时,还应该考虑该值获得的实验条件,应该是和被评估物质使用条件和品种敏感度最相关的。
如不能获得NOAEL值,也可以用观察到有害作用的最低剂量(LOAEL)或基准剂量(BMD)值代替,但用LOAEL值计算MoS时,应增加相应的不确定系数(一般为3倍)。
4.2.2对于无阈值原料的致癌性,可通过剂量描述参数T25等来进行剂量反应关系评价。
4.2.3皮肤致敏性评估可根据豚鼠最大值试验(GPMT)、Buehler局部封闭涂皮试验等。
4.3暴露评估
指通过对化妆品原料或风险物质暴露于人体的部位、强度、频率以及持续时间等的评估,确定其暴露水平。
4.3.1 对原料或风险物质进行暴露评价时应考虑含该原料的成品的使用部位、使用量、使用频率以及持续时间等因素,具体包括:
(1)用于化妆品中的类别。
(2)暴露部位或途径:皮肤、粘膜暴露,以及可能的吸入暴露。
(3)暴露频率:包括间隔使用或每天使用、每天使用的次数等。
(4)暴露持续时间:包括驻留或用后清洗等。
(5)暴露量:包括每次使用量及使用总量等。
(6)透皮吸收率。
(7)暴露对象的特殊性:如婴幼儿、儿童、孕妇、哺乳期妇女等。
(8)其它因素:如误用或意外情况下的暴露等。
4.3.2全身暴露量(SED)的计算
(1)如果原料的暴露是以每次使用经皮吸收μg/cm2时,根据使用面积,按以下公式计算:

其中:
SED:全身暴露量(mg/kg·bw/day)
DAa:经皮吸收量(μg/cm2),每平方厘米所吸收的原料的量,测试条件应该和产品的实际使用条件一致;在无透皮吸收数据时,吸收比率以100%计。
SSA:暴露于化妆品的皮肤表面积
F:产品的日使用次数(day-1)
BW:默认的人体体重(60 kg)
(2)如果原料的经皮吸收率是以百分比形式给予时,根据使用量,按以下公式计算:

其中:
SED:全身暴露量(mg/kg·bw/day)
A:考虑了残留率的以单位体重计的化妆品每天使用量(mg/kg·bw/day)。
C:原料在成品中的浓度(%)
DAp:经皮吸收率(%)。在无透皮吸收数据时,吸收比率以100%计,若当原料分子量?500道尔顿,且脂水分配系数Log Pow?-1或?4时,吸收比率取10%。[1]
暴露计算时还应考虑到化妆品的毒理作用(例如暴露需要计算皮肤的单位面积或单位体重)。应考虑其他暴露的可能性(如喷雾吸入,唇部用品非故意摄取等)。
4.4风险特征描述
指化妆品原料或风险物质对人体健康造成损害的可能性和损害程度。可通过计算安全边际值(MoS)、剂量描述参数T25或国际公认的致癌评估导则等方式进行描述。
4.4.1有阈值原料的风险特征描述
对于有阈值的化合物,通常通过计算其安全边际(MoS)进行评估。计算公式为:

其中:
MoS:安全边际。
NOAEL:未观察到有害作用的剂量
SED:全身暴露量(mg/kg·day)
在通常情况下, 当原料的MoS≥100时,可以判定是安全的,该值(MoS≥100)同样适用于儿童。
如化妆品原料的MoS<100,则认为其具有一定的风险性,对其使用的安全性应予以关注。
4.4.2无阈值原料的风险特征描述
对于无阈值的原料,可通过计算其终生致癌风险度(lifetime cancer risk ,LCR)进行风险程度的评估。终生致癌风险度(LCR)计算如下:
(1)首先按照以下公式将动物试验获得的T25转换成人T25(HT25):
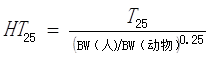
式中:
——T25诱发25%实验动物出现癌症的剂量
——HT25由T25转换的人T25
——BW 体重kg
(2) 根据计算得出的HT25以及暴露量按以下公式计算终生致癌风险:

式中:
—— LCR:终生致癌风险。
——SED:终生每日暴露平均剂量(mg/kg/day)
如果该原料的终生致癌风险度少于10-6,则认为其引起癌症的风险性较低,可以安全使用。
如果该原料的终生致癌风险度大于10-6,则认为其引起癌症的风险性较高,应对其使用的安全性予以关注。
5.毒理学研究
通过一系列毒理学研究,测定化妆品原料或风险物质的毒理学情况,将其作为危害识别的一部分,也是化妆品产品和原料风险评估的基础。
5.1 急性毒性
包括急性经口和/或经皮和/或吸入毒性试验资料等。可根据原料的用途及可能的暴露途径提供相应毒性资料。急性毒性试验是评估化妆品原料和风险物质毒性特性的第一步,通过短时间染毒可提供对健康危害的信息。试验结果可作为化妆品原料和风险物质毒性分级和标签标识以及确定亚慢性毒性试验和其它毒理学试验剂量的依据。
5.2刺激性/腐蚀性
包括一次性皮肤刺激性/腐蚀性试验和/或多次皮肤刺激性/腐蚀性试验、急性眼刺激性/腐蚀性试验等。确定和评价化妆品原料对哺乳动物皮肤局部或眼睛是否有刺激作用或腐蚀作用及其程度。
5.3皮肤致敏性
皮肤变态反应试验确定重复接触化妆品原料对哺乳动物是否可引起变态反应及其程度。
5.4皮肤光毒性
皮肤光毒性试验评价化妆品原料引起皮肤光毒性的可能性。
5.5致突变性/遗传毒性
致突变性/遗传毒性试验包括鼠伤寒沙门氏菌/回复突变试验、体外哺乳动物细胞染色体畸变试验、体外哺乳动物细胞基因突变试验、哺乳动物骨髓细胞染色体畸变试验、体内哺乳动物细胞微核试验、睾丸生殖细胞染色体畸变试验等。这些试验能够评价化妆品原料引起突变的可能性。原料的评估至少应包括一项基因突变试验和一项染色体畸变试验资料。
5.6亚慢性毒性
亚慢性毒性包括亚慢性经口毒性试验和亚慢性经皮毒性试验。
通过亚慢性经口毒性试验不仅可获得一定时期内反复接触受试物后引起的健康效应、受试物作用靶器官和受试物体内蓄积能力资料,并可估计接触的无有害作用水平,后者可用于选择和确定慢性试验的接触水平和初步计算人群接触的安全性水平。
通过亚慢性经皮毒性试验不仅可获得在一定时期内反复接触受试物后可能引起的健康影响资料,而且为评价受试物经皮渗透性、作用靶器官和慢性皮肤毒性试验剂量选择提供依据。
5.7发育和生殖毒性
发育和生殖毒性检测妊娠动物接触化妆品原料或风险物质后引起胎鼠畸形的可能性。
5.8 慢性毒性/致癌性
化学物质在体内的蓄积作用,是发生慢性中毒的基础。慢性毒性试验是使动物长期地以一定方式接触受试物引起的毒性反应的试验。
当某种化学物质经短期筛选试验证明具有潜在致癌性,或其化学结构与某种已知致癌剂十分相近时,而此化学物质有一定实际应用价值时,就需用致癌性试验进一步验证。动物致癌性试验为人体长期接触该物质是否引起肿瘤的可能性提供资料。
5.9毒代动力学
毒代动力学试验是定量地研究在毒性剂量下原料在动物体内的吸收、分布、代谢、排泄过程和特点,进而探讨原料毒性的发生和发展的规律,了解原料在动物体内的分布及其靶器官。
原料经过皮肤吸收后,其代谢转化可能会对其潜在毒性、体内分布和排泄造成重要影响。因此,在特定情况下,需要实施体内或体外生物转化研究,以证明或排除某些不良反应。
5.10透皮吸收
原料的透皮吸收试验资料。对于聚合物,如果其均重分子量超过1000,该部分资料可免于提供。
5.11 其它毒理学试验资料:必要时可提供其它有助于表明原料毒性的毒理学试验资料。
5.12人群安全性试验资料
包括人体安全性试验资料和人群流行病学资料。
原料在毒理学试验检测合格后,必要时进行人体皮肤斑贴试验,以检测其引起人体皮肤不良反应的潜在可能性。
收集含有原料的化妆品在人群中使用的安全性数据,包括人群流行病学调查、人群监测以及临床不良事件报告、事故报告等相关资料。
6.化妆品原料的风险评估
6.1风险评估原则
6.1.1逐一对化妆品原料和风险物质按照风险评估程序进行风险评估工作,保障原料使用的安全性。
6.1.2凡符合化妆品安全技术规范相关要求的防腐剂、防晒剂、着色剂、染发剂等肯定列表的原料,可免予风险评估。
6.1.3凡化妆品安全风险评估机构,如美国化妆品原料评估委员会(CIR)、欧盟消费者安全科学委员会(SCCS)等,已公布风险评估结论的原料,需对相关评估资料进行分析,在符合我国化妆品相关法规规定的情况下,可采用相关评估结论。如不同的权威机构评估结果不一致时,风险评估结论应从严采信。
6.1.4凡世界卫生组织(WHO)、联合国粮农组织(FAO)、经济合作与发展组织(OECD)、国内外政府等权威机构已公布安全限量(如:日允许摄入量、日耐受剂量、参考剂量等)的原料,需对相关评估资料进行分析,在符合我国化妆品相关法规规定的情况下,可采用相关评估结论。如不同的权威机构评估结果不一致时,风险评估结论应从严采信。并需要对原料的刺激性、腐蚀性等局部毒性另行进行风险评估。
6.1.5如香精符合国际日用香料协会(IFRA)标准,需对相关评估资料进行分析,在符合我国化妆品相关法规规定的情况下,可采用相关评价结论。
6.2化妆品原料的理化性质
原料的理化性质是最为关键的信息,它可以用于预测特定的毒理学特性。根据产品配方,逐一掌握所用原料的理化性质信息。应当包括以下内容:
6.2.1原料的名称
包括通用名称、商品名称、INCI名称、CAS号、EINCES号等。
6.2.2物理状态
如固体、液体、挥发性气体等。
6.2.3分子结构式和相对分子量
对于制剂,必须说明每个组成成分的分子结构式和相对分子量。
6.2.4化学特性和纯度
应说明表征化学特性时使用的技术条件(紫外光谱或红外光谱、核磁、质谱、元素分析等)以及检测结果等。
应明确原料的纯度以及测定方法,并验证分析方法的有效性。
在理化试验和毒性试验中使用的物质必须是市售产品中的代表物质。
6.2.6杂质或伴随污染物的特性
除了物质的纯度以外,还必须说明可能存在的杂质/残留物的浓度或含量。
6.2.7溶解度
应说明原料在水中和/或任何其他相关有机溶剂的溶解度。
6.2.8分配系数(Log Pow)
应说明分配系数。对于其计算值,应说明计算方法。
6.2.9其他相关的理化指标
如对于可吸收紫外线的成分,应说明化合物的紫外线吸收的波长及紫外线吸收光谱。
6.2.10均质性和稳定性
应报告试验条件下检测原料时用的试验溶液的均质性。
应报告实验条件下原料的稳定性。此外,也应说明该原料的储存条件。
6.2.11 UV-VIS吸收光谱
基于原料的结构,应提供UV-VIS吸收光谱。
6.2.12异构体组成
原料存在异构体时,各相关异构体也应进行风险评估。
6.2.13功能和用途
该原料拟用或已用于化妆品中的使用目的或功效、化妆品中拟或已使用的最高浓度等。如果化妆品成分用于喷雾剂或气溶胶,应该明确提及作为经由吸入暴露是可能的,并且应考虑到吸入暴露的风险评估。
此外,此原料作为其他用途(例如消费产品,工业产品)时,所用浓度也应尽可能描述。
6.3矿物、动物、植物和生物技术来源的原料
6.3.1.矿物来源的原料,应包括以下内容:
(1)原料来源;
(2)制备工艺:物理加工、化学修饰、纯化方法及净化方法等;
(3)特征性组成要素:特征性成分(%);
(4)组成成分的理化特性;
(5)微生物质量;
(6)防腐剂和/或其它添加剂。
6.3.2 动物来源的原料,应包括以下内容:
(1)物种来源(牛、羊、甲壳动物等)及器官组织(胎盘、血清、软骨等);
(2)原产国;
(3)制备过程:萃取条件、水解类型、纯化方法等;
(4)功效成分含量;
(5)形态:粉末、溶液、悬浮液等;
(6)特征性组成要素:特征性的氨基酸、总氮、多糖等;
(7)理化特性;
(8)微生物质量(包括病毒性污染);
(9)防腐剂和/或其它添加剂。
6.3.3植物来源的原料, 应包括以下信息:
(1)植物的通用名称;
(2)种属名称包括物种、属、科;
(3)所用植物的部分;
(4)感官描述:粉末、液态、色彩、气味等;
(5)形态解剖学描述;
(6)自然生态和地理分布;
(7)植物的来源包括地理来源及是否栽培或野生;
(8)具体制备过程:收集、洗涤、干燥、萃取等;
(9)储存条件;
(10)特征性组成要素:特征性成分;
(11)理化特性;
(12)微生物质量包括真菌感染;
(13)农药、重金属残留等;
(14)防腐剂和/或其它添加剂;
(15)如果是提取液,应说明包含的溶剂和有效成分的含量。
6.3.4生物技术来源的原料,应包括以下内容:
(1)制备过程;
(2)所用的生物描述:供体生物、受体生物、修饰微生物;
(3)宿主致病性;
(4)毒性成分包括生物代谢物、产生的毒素等;
(5)理化特性;
(6)微生物质量;
(7)防腐剂和/或其它添加剂。
对于特殊生物技术来源的原料,其中经修饰的微生物或潜在的毒性物质不能彻底去除的,需提供数据予以说明。
6.4香精香料
香精香料应具有国际日用香料协会(IFRA)标准或其他符合我国相关国家标准的证书,此外还应包括以下内容:
6.4.1原料在香料化合物中的半定量浓度(即,<0.1%; 0.1 <1%,1%至<5%,5%至<10%,10%至<20%,20%及以上);? 6.4.2对于天然原料,应具有以下信息
(1)该批次天然原料的组分分析;
(2)天然原料中组分的最高含量水平,应考虑到批间差异。
6.4.3应明确说明使用了最大浓度化合物的化妆品类型。
7.化妆品产品的安全评价
7.1评价原则
7.1.1根据化妆品所用原料的风险评估资料,结合产品的使用方式、使用量、残留等暴露水平,对化妆品产品进行风险评估,以确保产品安全性。
7.1.2 对化妆品中的各成分按照4.风险评估程序进行风险评估,凡符合化妆品技术规范相关要求的防腐剂、防晒剂、着色剂、染发剂等肯定列表的原料,可免予风险评估。
7.1.3对化妆品原料带入的、生产过程中产生或带入的风险物质按照4.风险评估程序进行风险评估。
7.1.4在完成化妆品成品的风险评估后,可以在满足伦理要求的前提下,通过人体皮肤斑贴试验,进一步排除化妆品产品的皮肤刺激性或致敏性。
7.1.5在我国化妆品相关规定中已有限量值的物质,不需要提供相关的风险评估资料;国外权威机构已建立相关限量值或已有相关评估结论的,申请人可以提供相应的风险评估报告等资料,不需要另行开展风险评估。如不同的权威机构评估结果不一致时,风险评估结论应从严采信。
7.1.6应针对每个产品编写风险评估报告,妥善保存,及时更新。
7.2产品理化稳定性评价
7.2.1对于上市的每个批次的化妆品产品,应控制以下相关理化参数:
(1) 物理状态;
(2) 制剂类型(水包油或油包水乳液、乳液、粉等);
(3) 感官特性(颜色、气味等);
(4) 水溶液制剂的pH值(在...℃条件下);
(5) 液体制剂的粘度(在...℃条件下);
(6) 根据具体需要的其他方面。
7.2.2确认原料之间是否存在化学、生物学相互关系,是否存在安全风险。
如有化学、生物学相互作用,应给出具体的理化实验数据,并进行风险评估。
7.2.3确保产品在运输、储存过程中不会发生影响质量安全问题的变化。
可通过稳定性实验数据和活性原料含量变化数据等进行说明。
7.2.4 对与内容物接触容器的物理稳定性以及与产品相容性进行风险评估。
可参考包装供应商的安全资料或安全声明等资料,对容器的物理稳定性进行风险评估。
7.2.5 对配方体系近似,包装材质相同的化妆品,可根据已有的资料和实验数据对理化稳定性开展风险评估工作,但需阐明理由,说明情况。
7.3产品微生物学评估
7.3.1 微生物污染物通常来自两个不同的来源,原料和生产过程中,以及消费者使用化妆品过程中。从化妆品包装开启时直至消费者最后一次使用该产品,由于周围环境和接触消费者的皮肤(手和身体),会不断地将各种不同微生物污染带入化妆品中。
为了确保产品质量和消费者的安全,有必要对上市的每批产品进行常规微生物检测。在现场报告中,应说明检查的项目、使用的标准和方法,以及在每个批次产品中获得的结果,并纳入到该批次产品的档案文件中。
7.3.2对于正在开发中的化妆品,应通过试验对其防腐剂的有效性进行评估,以确保贮存和使用过程中的微生物稳定性和防腐作用。在化妆品产品研发阶段应进行微生物挑战试验,通过试验数据评价该产品的防腐效能。
对于正常贮存和使用条件下可能变质或形成消费者感染风险物质的化妆品,应确保防腐剂的防腐效能。
7.3.3 对于防腐体系相同且配方近似的产品,可根据已有的资料和实验数据开展风险评估工作,但化妆品安全风险评估人员需阐明理由,说明情况。
7.4产品上市后的安全监测
7.4.1对上市后产品的安全性进行监测、记录和归档。包括正常使用和不当使用时发生的不良反应,消费者投诉以及后续随访等。
7.4.2如上市产品出现下列情况,需重新评估产品的安全性:
(1)上市产品所用原料在毒理学上有新的发现,且会影响现有风险评估结果的;
(2)上市产品的原料规格,发生足以影响现有风险评估结果变化的;
(3)上市产品不良反应出现连续、呈明显增加趋势,或出现了严重产品不良反应的;
(4)其他影响产品质量安全的情况。
8.安全风险评估报告
8.1化妆品原料的风险评估报告
化妆品原料的风险评估报告中一般应当包括的内容详见附录1。
8.2化妆品产品的安全评价报告
化妆品产品的安全评价报告中一般应当包括的内容详见附录2。
9. 术语和释义
下列术语和释义适用于本指南。
9.1化妆品(Cosmetics)
以涂擦、喷洒或者其他类似的方法,散布于人体表面任何部位(皮肤、毛发、指甲、口唇等),以达到清洁、消除不良气味、护肤、美容和修饰目的的日用化学工业产品。
9.2化妆品原料(Ingredients)
是指化妆品配方中使用的成分。
9.3安全性风险物质(Risk Substances)
由化妆品原料带入、生产过程中产生或带入的,可能对人体健康造成潜在危害的物质。
9.4危害(Hazard)
原料或杂质在暴露情况下对人体产生不良影响的属性。
9.5风险(Risk)
消费者暴露条件下,原料或杂质对使用者产生有害作用的概率及特征。
9.6剂量(Dose)
直接与机体的吸收部位(消化道、粘膜、皮肤等)接触,可供吸收的量,通常以mg/kg·bw表示。
9.7未观察到有害作用的剂量(No Observed Adverse Effect Level,简称:NOAEL)
在规定的暴露条件下,通过实验和观察,化学物质不引起机体可检测到的有害作用的最高剂量或浓度。
9.8观察到有害作用的最低剂量(Lowest Observed Adverse Effect Level,简称:LOAEL)
在规定的暴露条件下,通过实验和观察,化学物质引起机体损害的最低剂量或浓度。
9.9基准剂量(Benchmark Dose,简称:BMD)
一种物质引起某种特定的、较低健康风险发生率(一般在1%~10%之间)的剂量;该剂量与某种生物效应的明确度量或改变有关。
9.10有阈值化学物质(Threshold Compounds)
在一定的暴露剂量以下,对动物或人不发生有害作用的化学物质,包括非致癌物和非遗传毒性的致癌物。
9.11无阈值化学物质(Non- Threshold Compounds)
多为遗传毒性的致癌物,是已知或假设其作用是无阈值的,即已知或假设大于零的所有剂量都可以诱导出有害作用的化合物。
9.12全身暴露量(Systemic Exposure Dosage,简称:SED)
通过各种暴露途径进入体循环的化学物质的预计量。通常以mg/kg·bw/day表示。
9.13安全边际(Margin of Safety,简称:MoS)
从合适的试验得到的实验性NOAEL与预期的全身暴露量之间的比值。
9.14可接受风险度(Acceptable Risk)
能够为社会公认并能为公众接受的终生致癌风险概率,通常应小于10-6,可因时间、地点、条件和公众的接受能力而不同。
9.15 T25
对自发肿瘤发生率进行校正后,25%的实验动物的某部位有发生肿瘤的剂量。可由慢性毒性/致癌性试验得出。
9.16日允许摄入量(Acceptable Daily Intake,简称:ADI)
是指人终生每日从食物或饮水中摄入某种化学物质,对健康无任何已知不良效应的剂量。
9.17日耐受剂量(Tolerable Daily Intake,简称:TDI)
是指人终生每日摄入某种有害物质,对健康无任何已知不良效应的剂量。
9.18 参考剂量(Reference Dose,简称:RfD)
环境介质(空气、水、土壤、食品等)中化学物质的日平均接触剂量的估计值,人群(包括敏感亚群)在终生接触该剂量水平下,预期一生中发生非致癌或非致突变有害效应的危险度可接受或可忽略的程度。
9.19不良反应(Undesirable Effect)
不良反应是指长期使用化妆品所引起的皮肤及其附属器官的病变,以及人体局部或全身性的损害。但因生产、职业性接触化妆品或者使用假冒、不合格产品引起的病变或者损害不属于本《指南》所称不良反应。
附录1
化妆品原料的风险评估报告
题目:(原料名称)风险评估报告
评估单位:
评估人:
评估日期:����年��月��日
一、风险评估摘要:
二、原料特性描述:
1. 名称:(包括化学名、通用名、商品名、INCI名、 CAS号、EINCES号)
2. 分子式及结构式:
3.性状:
4.溶解性:
5.稳定性:
6.pH值:
7.分配系数:
8.纯度:
9.杂质及含量:
10.使用目的或功效:
11.使用浓度:
12.其它:如为矿物、动物、植物和生物技术来源的原料或香精香料,按照本指南中的要求进行原料特性描述。
三、风险评估过程:
1. 危害识别:
1.1 毒理学终点:
(1) 急性毒性
(2) 刺激性/腐蚀性
(3) 皮肤致敏性
(4) 皮肤光毒性
(5) 致突变性/遗传毒性
(6) 亚慢性毒性;
(7) 发育和生殖毒性;
(8) 慢性毒性/致癌性;
(9) 毒代动力学;
(10) 人群安全资料。
1.2 危害识别:
2. 剂量反应关系评估:
3. 暴露评估:
4. 风险特征描述:
四、风险评估结果的分析:包括对风险评估过程中资料的完整性、可靠性、科学性的分析,数据不确定性的分析等。
五、风险控制措施或建议:
六、原料风险评估结论:
七、特殊说明:
八、证明性资料,包括:所涉文献资料内容、检测报告、涉及的原料规格证明等。若存在风险物质,应提供风险物质评价结论和资料,或产品的风险物质检验报告。
附录2
化妆品产品的安全评价报告
题目:(产品名称)安全评价报告
产品配方号:
评估单位:
评估人:
评估日期:����年��月��日
一、安全评价摘要:
二、产品特性描述:
1.产品名称:
2.产品配方(应包含各原料使用目的):
3.各原料理化信息:
4.可能存在的风险物质信息:
5.使用方法:
6.使用目的或功效:
7.使用量:
8.其他:
三、化妆品各原料或风险物质的风险评估过程:
1. 危害识别:
1.1 毒理学终点:
(1) 急性毒性
(2) 刺激性/腐蚀性
(3) 皮肤致敏性
(4) 皮肤光毒性
(5) 致突变性/遗传毒性
(6) 亚慢性毒性;
(7) 发育和生殖毒性;
(8) 慢性毒性/致癌性;
(9) 毒代动力学;
(10) 人群安全资料。
1.2 危害识别:
2. 剂量反应关系评估:
3. 暴露评估:
4. 风险特征描述:
四、安全风险评估结果的分析:包括对风险评估过程中资料的完整性、可靠性、科学性的分析,数据不确定性的分析等。
五、安全风险控制措施或建议:
六、化妆品产品安全评价结论:(包括产品理化稳定性评价结论;产品微生物学评估结论;产品或配方类似产品的人体安全数据,包括:临床数据、消费者使用调查、不良反应记录等。)
七、证明性资料,包括:所涉文献资料内容、检测报告、涉及的原料规格证明等。
八、特殊说明:
1、如果产品配方中两种或两种以上的原料,其可能产生系统毒性的作用机制相同,在计算安全边际时应考虑累积暴露,并进行具体的个案分析;
2、全新配方或全新技术生产的产品,在原料安全风险评估判定安全性的基础上,应当进行人体斑贴试验或人体试用试验来验证产品不会产生局部毒性。否则,应当采用传统的终产品毒理学试验的方法进行产品安全性评价。
[1]若不是按照最保守的100%经皮吸收率来计算,而要通过体外试验来细化真实使用条件下的经皮吸收率时,体外试验所用的剂量、浓度和总量应未超过拟使用条件,否则将低估使用过程中的真实吸收率。

