坚持就是胜利 努力就有成功
化学计量在实验中的应用练习题
1.若某原子的摩尔质量是Mg·mol,则一个该原子的真实质量是( )
A.Mg B.-11
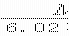
g C.Mg D.g
2.若50滴水正好是mmL,则1滴水所含的分子数是( )
A.m×50×18×6.02×10 B.23×6.02×10 C.23×6.02×10
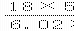
D.23
3.在标准状况下,若VL甲烷中含有的氢原子个数为n,则阿伏加德罗常数可表示为( ) A.Vn22.4nVn5.6n B. C. D. 22.4V5.6V
4.有一真空瓶质量为m1,该瓶充入空气后质量为m2。在相同状况下,若改为充入某气体A时,总质量为m3。则A的相对分子质量是( ) A.mmm2×29 B.3×29 C.3
m1m1m2?m1×29 m1 D.m2m3?m1×29 m1
5.同温同压下,气体A与氧气的质量比为1∶2,体积比为1∶4,气体A的相对分子质量是
A.16 B.17 C.44 D.64
6.下列数量的物质中含原子数最多的是( )
A.0.4mol氧气 B.标准状况下5.6L二氧化碳 C.4℃时5.4mL水 D.10g氖
-17.300mL某浓度的NaOH溶液中含有60g溶质。现欲配制1mol·LNaOH溶液,应取原溶液与蒸馏水的体积比约为
( )
A.1∶4 B.1∶5 C.2∶1 D.2∶3
8.同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是( )
A.密度比为16∶11 B.密度比为11∶16 C.体积比为16∶11 D.体积比为11∶16
149.nmolN2和nmolCO相比较,下列叙述中正确的是( )
A.在同温同压下体积相等 B.在同温同压下密度相等 C.在标准状况下质量相等 D.分子数相等
-310.将标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm,则该盐酸的物质的量浓度是( ) A.aabab1000ab-1 -1-1 -1 mo1·LB.mol·L C.mol·LD.mol·L22.4224002240036.5a2240036.5a
11.如果ag某气体中含有的分子数为b,则cg该气体在标准状况下占有的体积应表示为(式中NA为阿伏加德罗常数( )A.22.4bc22.4ab22.4bc22.4bL B.L C.L D.L aNAcNAbNAacNA
12.某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是
A.所用NaOH已经潮解 B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里 D.用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法
13.在4℃时向100mL水中溶解了22.4LHCl气体(标准状况下测得)后形成的溶液。下列说法中正确的是( )
A.该溶液物质的量浓度为10mol·L-1 B.该溶液物质的量浓度因溶液的密度未知而无法求得
1
坚持就是胜利 努力就有成功
C.该溶液中溶质的质量分数因溶液的密度未知而无法求得 D.所得溶液的体积为22.5L
14.下列叙述中,正确的是( )
A.在标准状况下,1mol任何物质的体积为22.4L
B.等物质的量浓度的盐酸和硫酸中,H+的物质的量浓度也相等
C.1molH2和1molHe中,所含的分子数相同、原子数相同、质量也相同
D.体积为6L的O2,其质量可能为8g
15.配制0.25mol·L-1的NaOH溶液100mL,某学生操作如下:
①用托盘天平称出1.00g氢氧化钠:将天平调好零点,再在两盘上各取一张同样质量的纸,把游码调到1.00g的位置上,于左盘放粒状氢氧化钠至天平平衡,取下称好的氢氧化钠,并撤掉两盘上的纸。
②把称好的氢氧化钠放入一只100mL的烧杯中,加入约10mL水,搅拌使之溶解,溶解后立即用玻璃棒引流将溶液移至一只100mL的容量瓶内,加水至离刻度线约2cm处,用滴管加水至刻度线。 ③写出一个标有配制日期的“0.25mol·L-1NaOH溶液”的标签,贴在容量瓶上密闭保存。指出上述操作中的7处错误:
(1)_________;(2)_________________ (3)______________;(4)__________________
(5)_____________;(6)_______________ (7)________________
16.某固体仅由一种元素组成,其密度为5g·cm-3,用X射线研究该固体的结构表明,在棱长为1×-710cm的立方体中含有20个原子,求此元素的近似相对原子质量。
17.(1)用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制100mL1.84mol·L-1的稀硫酸,若实验仪器有:A.100mL量筒;B.托盘天平;C.玻璃棒;D.50mL容量瓶;E.10mL量筒,F.胶头滴管;G.50mL烧杯;H.100mL容量瓶,实验时应选用仪器的先后顺序是(填入编号):________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填编号)________。
A.使用容量瓶前检查它是否漏水B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2~3cm处,用滴管加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后,直接倒入容量瓶中,缓慢加入蒸馏水到标线 E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
F.往容量瓶中转移溶液时应用玻璃棒引流
18. 已知某饱和氯化钠溶液体积为VmL溶液密度为dg/cm3,质量分数为w%,物质的量浓度为Cmol/L,溶液中含NaCl的质量为mg。
(1)用w表示在该温度下NaCl的溶解度是 。
(2)用m、V表示溶液的物质的量浓度是 。
(3)用w、d表示溶液的物质的量浓度是 。
2
坚持就是胜利 努力就有成功
(4)用c、d表示溶液的质量分是
答案及详解:
1.C 解析:摩尔质量指的是1摩尔物质的质量,即6.02×1023个粒子的质量,因此一个该原子的真实质量可用g表示。
2.B 解析:由已知,1滴水的体积为mL,又因为H2O的密度为lg·mol-3,故1滴水的质量即为g,相当于mol,所含的分子数为:×6.02×1023,答案选B。
3.D 解析:设阿伏加德罗常数为,则依题意,可得:×4=故=,选D。
4.C 解析:不管在瓶中充入何种气体,在相同状况下,其体积和物质的量均是相等的。设A的相对分子质量是,则根据=,得=×29。故应选C。
5.D解析:设气体A的相对分子质量为,即A的摩尔质量为g·mol-1。根据阿伏加德罗定律,同温同压下,气体的体积比应等于其物质的量之比。则有;∶=l∶4,故=64,选D。
6.C 解析:物质中所含原子的物质的量最多,则物质中含原子数量最多,0.4molO2中含0.8mol原子;标准状况下5.6LCO2中所含原子为:×3=0.75mol;4℃时5.4mLH2O中含原子为:×3=0.9mol;10gNe中所含原子为:=0.5mol。
7.A 解析:依题意,原NaOH溶液的浓度是==5mol·L-1。
设原溶液与水混合时体积不变,则以体积比1∶4稀释即成试题所要求的溶液。因此,选项A是本题答案。
8.AD 解析:同温同压下,气体密度比等于相对分子质量之比:===,同温同压下,等质量的气体体积比等于相对分子质量的反比,即=。
9.AD 解析:首先要理解题意,molN2和mol14CO是物质的量相等的两种气体,根据阿伏加德罗定律,可以判断A正确。
N2和14CO的摩尔质量不相等(N2∶28g·mol-1,而14CO:30g·mol-1),molN2和nmol14CO的质量不相等,同温同压下,它们体积相等,所以它们的密度一定不相等,在标准状况下,也属于同温(0℃)、同压(1.01×105Pa),所以它们只是体积相等,而质量不等,两种气体的物质的量相等,它们的分子数一定相等。
10.D 解析:要求溶液的物质的量浓度,需知溶质的物质的量和溶液的体积。溶液的体积不等于HCl(g)的体积,也不等于HCl(g)和H2O的体积之和,而要根据溶液的密度求得:
〔HCl(aq)〕=
11.A 解析:这是一道考查物质的量概念的选择题,正确的解题思路是从g气体中含有的分子数为入手,用除以阿伏加德罗常数求出g气体的物质的量,再乘以气体摩尔体积,求出g气体在标准状况下占有的体积,即=×22.4L,然后,列比例式求出g该气体在标准状况下占有的体积,即=,=。
12.B 解析:A、C、D都将造成溶质的物质的量偏小,故所配溶液的浓度偏低。只有B会造成溶液体积偏小,故浓度偏高。
13.B 解析:本题主要考查学生对物质的量浓度的概念的理解并巩固溶液中溶质质量分数的概念及相关计算。溶液的物质的量浓度等于溶质的物质的量除以溶液的体积,而不是除以溶剂的体积。向100mL水中溶解了22.4L气体后,溶液体积会发生一些变化,不再是原来的100mL。
(0.1L)也不等于22.5L而必须已知溶液的密度才能求出溶液的体积。本题中溶剂的质量等于1g·mL-1×100mL=100g,溶质的质量等于×36.5g·mol-1=36.5g,故可求出溶液中溶质的质量分数。
A项因溶液的体积不等于0.1L,而推知物质的量浓度不等于10mol·L-1。C项不难求出溶质质 3
坚持就是胜利 努力就有成功
量为36.5g,溶剂质量为100g,故可求出溶质质量分数×100%=26.7%。D项溶液的体积不等于溶剂和溶质的体积之和,故所得溶液的体积不等于22.5L。所以本题答案为B。
14.D 解析:本题全面考查本章的几个重要概念。不仅要理解每个概念的含意,更要弄清各个概念的来龙去脉及应用前提。A考查的是气体摩尔体积,其适用范围是气体,而不是任何物质;B考查的是物质的量浓度与溶液中粒子个数的关系。因盐酸是一元强酸,硫酸是二元强酸,故物质的量浓度相等的盐酸和硫酸中,H+的物质的量浓度后者应是前者的两倍;C考查的是物质的量与所含粒子(包括分子和原子)、物质的量与物质,的质量之间的关系。D考查的是对气体摩尔体积的概念的理解。6LO2可能是在非标准状况下,在这条件下气体摩尔体积可能为24L·mol-1,则该状况下的6LO2的物质的量为0.25mol,质量为32g·mol-1×0.25mol=8g。
15.(1)NaOH应放在干燥的烧杯中称量
(2)用过的游码未拨回原处
(3)托盘天平只能称出0.1~0.2g,称不出1.00g
(4)烧杯和玻璃棒未洗涤,洗涤液亦应转入容量瓶
(5)溶解NaOH应冷却后再转移至容量瓶中
(6)容量瓶中的溶液未摇匀
(7)配好的溶液应及时转移到有胶塞的试剂瓶内
16.20个原子的质量=·=(1×10-7cm)3×5g·cm-3=5×10-21g,则该元素原子的摩尔质量=5×10-21g×=150g·mol-1。所以该元素的近似相对原子质量为150。
解析:求元素的相对原子质量,应先求出该元素原子的摩尔质量,二者数值相等。据题意若可求出20个原子的质量,则可计算出(取值为6.02×1023)个原子的质量,即1mol原子的质量。 点评:解题过程中学会应用以前学过的知识如=·和新知识摩尔质量、质量、阿伏加德罗常数之间的联系。由=和=可得==·,此种推导方法常应用在解题当中。
17.(1)EFGCHF
(2)BCD
解析:本题是一道溶液稀释、质量分数与物质的量浓度之间的换算计算及物质的量浓度溶液配制实验操作题。(1)据稀释规律=及质量分数换算为物质的量浓度的关系,先求出,再求出。==18.4mol·L-1,===0.01L=10mL,则需用浓H2SO4的体积为10mL,所以选10mL量筒,若用100mL量筒则会使量取的溶液体积误差变大。问题(2)主要涉及的是容量瓶的使用方法,容量瓶只能用来定容(定容时标示的温度为20℃),不能用来稀释或溶解物质,也不能长期存放溶液,因为稀释或溶解的过程中将有热效应,影响溶液的容积测定;使用容量瓶之前只能用蒸馏水洗涤,不能用待配溶液润洗容量瓶,若用待配溶液润洗会使溶质附着在容量瓶内壁,引起配制溶液浓度偏高。
点评:物质的量浓度溶液的配制实验是中学实验中的一个重要实验,不仅要掌握一些常用仪器(容量瓶、量筒、天平、胶头滴管、玻璃棒、烧杯等)的使用方法,还应学会实验的误差分析。 4
第二篇:高一化学必修1 第一章第二节 化学计量在实验中的应用(第2课时)教案
第二节 化学计量在实验中的应用
第2课时
教学目标
知识与技能:
1、进一步巩固物质的量的概念及其与质量、摩尔质量、物质的量、物质的粒子数之间的相互关系
2、知道气体摩尔体积的概念,学会有关气体摩尔体积的简单计算
过程与方法:
1、初步学会分析处理数据、推理演绎、归纳总结的科学学习方法
情感态度与价值观:
1、体验发现问题、分析问题、解决问题的探究性学习过程
2、通过理解并运用概念,形成严谨的科学态度和严谨务实、循序渐进、探索真理的科学态度,形成科学归纳的思维能力、空间想像能力和运用事物规律分析解决问题的能力
重点难点气体摩尔体积的概念及其简单计算
教学过程
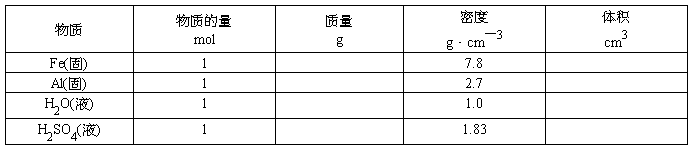
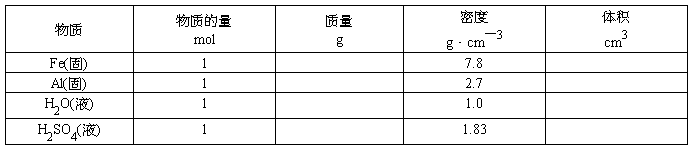
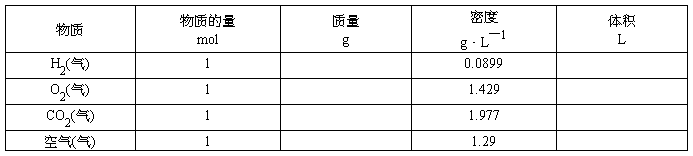
〖引入〗通过学习我们已经知道,1mol任何粒子的集合体所含的粒子数目,1mol粒子的质量。那么1mol物质的体积是否相同呢?下面通过计算来证明。
〖投影〗

温度0°C、压强101 kPa
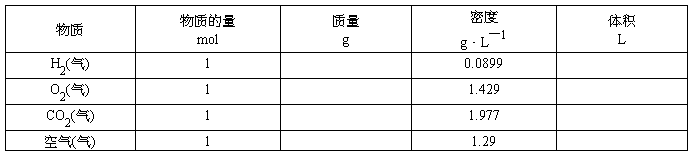
〖结论〗在温度和压强一定时,物质的体积主要由物质所含①、②、③决定。当粒子数相同,粒子间距离很小时,决定物质体积大小的主要因素是构成物质的;粒子间距离很大时,决定物质体积大小的主要因素是粒子。
〖小结〗1、物质在固态或液态时,粒子间的平均距离比气态小得多,决定固体、液体的体积的主要因素是,由于粒子的大小是不同的,所以,1mol不同的固态或液态物质的体积是。而气体物质分子之间的距离很大,故气体物质的体积主要决定于。
2、决定粒子间距离的主要因素是温度和压强(有何影响?),不同气体在相同的温度和压强下,分子之间的距离可以看作是的,所以,粒子数相同的气体在相同条件下有着近似相同的体积。在相同温度和压强下,相同体积的任何气体应含有相同数目的粒子,这就是著名的阿伏加德罗定律。
〖注意〗 1、气体的体积受温度、压强的影响很大,因此,说到气体的体积时,必须指明外界条件,否则就没有意义。
2、单位物质的量的气体所占的体积称为,用(符号)表示,单位为,那么在一定温度和压强下,Vm是个常数,如果条件变化了,则Vm亦随之改变。如在0℃、101 kPa时,Vm=;在25℃、101 kPa时,Vm=。
〖归纳〗归纳得出公式:气体体积V=
〖小结〗构建知识网络——小结物质的量、质量、粒子数、气体体积之间的相互关系
补充习题
1、标准状况下,2.2 g CO2的体积是多少?
2、标准状况下10g氢气的体积是多少升?6.72L二氧化碳气体的质量为多少克?
3、现有3.4 g H2S和0.1 mol HBr气体。
(1)不同条件下,哪个分子数较多?
(2)相同条件下,哪个该用较大的容器装?
(3)不同条件下,哪个质量大?大多少?
(4)哪个所含H原子的物质的量多?多多少?
(5)其中含S和Br各多少克?
4、标准状况下有(1)6.72LCH4(2) 3.01×1023个HCl分子 (3)13.6gH2S,下列对这三种气体的关系从小到大的排列顺序是:
A、物质的量______________ B、体积___________________
C、质量__________________ D、氢原子数_______________
5、N2、CO2、SO2三种气体的质量比为7:11:16时,它们的分子个数比为___________;物质的量之比为___________;同温同压下体积比为________
 教学反思:
教学反思:
教师备课:
〖引入〗通过学习我们已经知道,1mol任何粒子的集合体所含的粒子数目都相同,1mol粒子的质量不同。那么1mol物质的体积是否相同呢?下面通过计算来证明。
〖投影〗
温度0°C、压强101 kPa
〖结论〗在温度和压强一定时,物质的体积主要由物质所含①物质所含粒子的数目、②粒子的大小、③粒子之间的距离决定。当粒子数相同,粒子间距离很小时,决定物质体积大小的主要因素是构成物质的粒子大小;粒子间距离很大时,决定物质体积大小的主要因素是粒子之间的距离。
〖小结〗1、物质在固态或液态时,粒子间的平均距离比气态小得多,决定固体、液体的体积的主要因素是粒子的大小,由于粒子的大小是不同的,所以,1mol不同的固态或液态物质的体积是不相同的。而气体物质分子之间的距离很大,故气体物质的体积主要决定于粒子间的距离。
2、决定粒子间距离的主要因素是温度和压强(有何影响?),不同气体在相同的温度和压强下,分子之间的距离可以看作是相同的,所以,粒子数相同的气体在相同条件下有着近似相同的体积。在相同温度和压强下,相同体积的任何气体应含有相同数目的粒子,这就是著名的阿伏加德罗定律。
〖注意〗 1、气体的体积受温度、压强的影响很大,因此,说到气体的体积时,必须指明外界条件,否则就没有意义。
2、单位物质的量的气体所占的体积称为气体摩尔体积,用Vm(符号)表示,单位为L/mol,那么在一定温度和压强下,Vm是个常数,如果条件变化了,则Vm亦随之改变。如在0℃、101 kPa时,Vm=22.4 L/mol;在25℃、101 kPa时,Vm=24.8 L/mol。
〖归纳〗归纳得出公式:气体体积V=n?Vm
〖小结〗构建知识网络——小结物质的量、质量、粒子数、气体体积之间的相互关系
补充习题
1、标准状况下,2.2 g CO2的体积是多少?(0.05×22.4升)
2、标准状况下10g氢气的体积是多少升?6.72L二氧化碳气体的质量为多少克?
答案:氢气的体积5×22.4升 二氧化碳气体的质量为0.3×44g
3、现有3.4 g H2S和0.1 mol HBr气体。
(1)不同条件下,哪个分子数较多? 相同
(2)相同条件下,哪个该用较大的容器装? 相同
(3)不同条件下,哪个质量大?大多少? (HBr大 8.1—3.4=4.7)
(4)哪个所含H原子的物质的量多?多多少?( H2S多 多6.8-0。1=6.7)
(5)其中含S和Br各多少克? S的质量为:(3.2克Br的质量为:8克)
4、标准状况下有(1)6.72LCH4(2) 3.01×1023个HCl分子 (3)13.6gH2S,下列对这三种气体的关系从小到大的排列顺序是:
A、物质的量_CH4__HCl____H2S_______ B、体积__CH4__HCl____H2S____
C、质量__HCl__H2S___ CH4______ D、氢原子数_CH4___H2S____HC_
5、N2、CO2、SO2三种气体的质量比为7:11:16时,它们的分子个数比为_1:1:1____;物质的量之比为_1:1:1___;同温同压下体积比为__1:1:1___

