实 习 报 告

邵 阳 学 院
2011 年 1 月6日
一 实习时间、地点和实习单位
时间: 20##年12月27日到20##年1月3日
地点: 邵阳学院3栋505、207
单位: 邵阳学院生物与化学工程系
二 实习过程概述
通过夏湘老师的悉心指导,我们在20##年12月27日到20##年1月3日内完成了对水样的测定。具体过程如下:
12月27日领取实验仪器以及所需药品,熟悉实验原理以及实验流程。配制了实验所需溶液,并完成了水样中铁含量的测定试验。
12月28日对水样中铜含量的测定实验中的中间标准铜溶液及样品进行了处理,并完成了水样中溶解氧的测定实验。
12月29日用重铬酸钾标准溶液准确标定了硫酸亚铁铵溶液的浓度,并完成了水样中化学含氧量的测定实验。
1月3日完成了对水样中铜含量的测定实验中的中间标准铜溶液及样品在原子吸收分光光度计进行了吸光度的测定,整理实验药品及仪器并归还给管理老师。
三实习单位和实习内容
1.实习单位邵阳学院生物与化学工程系
08化学分析化学课程实习第四小组
实验参与人员:28号 赵晶
26号 苑春歌
43号 刘田英
95号 陈清烨
112号 谭周
117号 颜家林
2.实习内容
2.1水样中铁的测定——1,10-邻二氮菲分光光度法
l 常规分析项目及质量技术指标
水质常规指标及限值(感官性状和一般化学指标)
色度(铂钴色度单位) 15
浑浊度(NTU-散射浊度单位) 1
水源与净水技术条件限制时为3
臭和味 无异臭、异味
肉眼可见物 无
pH (pH单位) 不小于6.5且不大于8.5
铝(mg/L) 0.2
铁(mg/L) 0.3
锰(mg/L) 0.1
铜(mg/L) 1.0
锌(mg/L) 1.0
氯化物(mg/L) 250
硫酸盐(mg/L) 250
溶解性总固体(mg/L) 1000
总硬度(以CaCO3计,mg/L) 450
耗氧量(CODMn法,以O2计,mg/L) 3
水源限制,原水耗氧量>6mg/L时为5
挥发酚类(以苯酚计,mg/L) 0.002
阴离子合成洗涤剂(mg/L) 0.3
1实验原理
在pH3~9时,Fe2+与邻二氮菲(又称邻菲罗啉)作用生成稳定的橙红色的配合物:
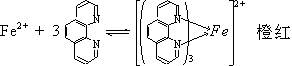
该配合物在508nm波长处具有最大吸收,ε508=1.1×104L·mol-1·cm-1。
用还原剂(如盐酸羟胺)将Fe3+还原为Fe2+,则本法可测定Fe3+及铁的总量。
2 适用范围
本法适用于地表水、地下水及废水中铁的测定。方法的最低检出浓度为0.03mg/L,测定下限为0.12mg/L,测定上限为5.0mg/L。对铁离子浓度高于5.0mg/L的水样,可适当稀释后按本法测定。
3 主要仪器
722型分光光度计,50mL具塞比色管或容量瓶6只。
4 试剂
除非另有说明,实验时所用试剂均为符合国家标准的分析纯试剂,试验用水均为蒸馏水或同等纯度的水。
4.1 HCl,GR,ρ20=1.18g/mL。
4.2 (1+3)HCl,用(4.1)HCl配制。
4.3 10%(m/V)盐酸羟胺溶液。
4.4 HAc-NH4Ac缓冲溶液:40g乙酸铵溶于适量水中,加50mL冰乙酸,用水稀释至100mL。
4.5 0.5%(m/V)1,10-邻二氮菲水溶液,加数滴盐酸帮助溶解。
4.6 铁标准贮备液
准确称取0.7020g硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O,溶于50mL(1+1)硫酸中,定量转移至1000mL容量瓶中,以水定容,摇匀。此溶液1.00mL含100μg铁。
4.7 铁标准使用液
准确移取25.00ml铁标准贮备液(4.6)置于100mL容量瓶中,以水定容,摇匀。此溶液1.00mL含25.0μg铁。
5 干扰的消除
强氧化剂、氰化物、亚硝酸盐、焦磷酸盐、偏聚磷酸盐及某些重金属离子会干扰测定。经过加酸煮沸可将氰化物及亚硝酸盐除去,并使焦磷酸盐,偏聚磷酸盐转化为正磷酸盐以减轻干扰。加入盐酸羟胺可消除强氧化剂的干扰。
邻菲罗啉与某些金属离子形成有色配合物而干扰测定。但在乙酸-乙酸铵缓冲溶液中,不大于铁浓度10倍的铜、锌、钴、铬及少于2mg/L的镍,不干扰测定,当浓度更高时,可加入过量显色剂予以消除。汞、镉、银等能与邻菲罗啉形成沉淀,若浓度低时可加入过量邻菲罗啉来消除,若浓度高时,可将沉淀过滤除去。水样有底色,可用不加邻菲罗啉的试液作参比,对水样的底色进行校正。
6 测定步骤
6.1 校正曲线的绘制
依次吸取铁标准使用液0.00,2.00,4.00,6.00,8.00,10.00mL置150mL锥形瓶中,加蒸馏水至50mL,再加1mL(1+3)盐酸,1mL 10%盐酸羟胺,玻璃珠1~2粒,加热煮沸至溶液剩15mL左右,冷却至室温,定量转移至50mL具塞比色管中。加一小片刚果红试纸,滴加饱和乙酸钠溶液至试纸刚刚变红,加5mL乙酸-乙酸铵缓冲溶液,2mL0.5%邻菲罗啉溶液,加水至标线,摇匀。显色15min后,用1cm比色皿,以水为参比,在510nm处测定吸光度,由经过空白校正的吸光度对铁的质量(μg)作图。
6.2 总铁的测定
采样后立即将样品用盐酸(4.1)酸化至pH<1(含CN-或S2-的水样酸化时,必须小心进行,因为会产生有毒的气体),分析时取50.00mL水样于150mL锥形瓶中,加1mL(1+3)盐酸,1mL 10%盐酸羟胺,加热煮沸至体积减少到15mL左右,以保证全部铁的溶解和还原。若仍有沉淀应过滤除去。以下按绘制标准曲线同样操作,测定吸光度并作空白校正。
7 实验数据记录及处理
标准曲线的绘制

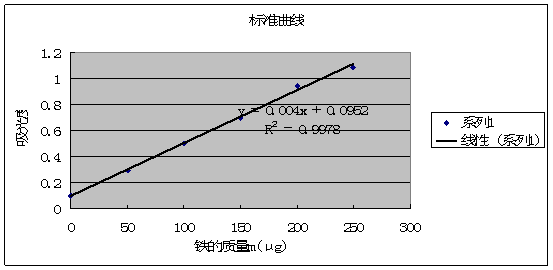
自来水A:0.195 0.195 =0.004x+0.0952 x=24.95
Fe(mg/L)=m/V
式中:m——根据校准曲线计算得到的水样中铁的含量,μg;
V——取样体积,mL。
此自来水Fe(mg/L)=24.95/50=0.499
而方法的最低检出浓度为0.03mg/L,测定下限为0.12mg/L,测定上限为5.0mg/L。故此方法合适且测之前不必要稀释。从水质常规指标及限值中可知生活用水Fe含量不能超过0.3mg/L,由此可以看出自来水已超出标准。
2.2水样中铜含量的测定——石墨炉原子吸收分光光度法
1 原理
铜的分析线324.7nm。将样品或经消解处理过的样品注入石墨炉中,经干燥、灰化和原子化后,产生的基态原子蒸气对其特征谱线产生选择性吸收,其吸光度与溶液浓度的关系服从比尔定律,用标准曲线法定量。
溶解的金属:未酸化的样品能通过0.45μm滤膜的金属成分。
金属总量:未经过滤的样品强烈消解后测得的金属浓度,或样品中溶解和悬浮的两部分金属的总量。
2 测定范围
火焰法:0.05~5mg/L铜;石墨炉法:1~50μg/L铜。
3 主要仪器
原子吸收分光光度计(附石墨炉),100mL容量瓶7个,1000mL容量瓶2个。
4 试剂
除非另有说明,实验时所用试剂均为符合国家标准的分析纯试剂,试验用水均为蒸馏水或同等纯度的水。
4.1 硝酸,GR;
4.2 硝酸;
4.3 高氯酸(可用硫酸代替),GR;
4.4 1+1硝酸,用(4.2)硝酸配制;
4.5 1+499硝酸,用(4.1)硝酸配制;
4.6 铜标准贮备液:1.000g/L。
准确称取0.0500g光谱纯铜,用硝酸(4.1)溶解,必要时加热,直至溶解完全,然后用蒸馏水定容至50mL。1.00mL此溶液含1.00mg铜。(m(纸)=0.2680、m(纸+铜)=0.3180)
4.7 中间铜标准溶液:1.00mg/L。
准确吸取0.25mL铜标准贮备液置于250mL容量瓶中,用1+499硝酸定容。1.00mL此溶液含1.00μg铜。
5 样品的采集
用聚乙烯瓶采集样品,采样瓶需要用洗涤剂洗净,再在1+1硝酸溶液中浸泡,使用前用水冲洗干净。分析金属总量的样品,采样后立即加硝酸(4.1)酸化至pH1~2,正常情况下每1000mL水样加2mL硝酸。
分析溶解的金属时,样品采集后立即用0.45μm滤膜过滤,得到的滤液再按以上操作酸化。
6 测定步骤
6.1 样品处理
取100.0mL样品,置于200mL烧杯中,加5mL硝酸(4.1),在电热板上加热消解,确保样品不沸腾,蒸至10mL左右,加入5mL硝酸(4.1),2mL高氯酸(GR可用硫酸代替),继续消解,蒸至1mL左右。取下冷却,小心加水溶解残渣。用中速滤纸(预先用1+499硝酸洗)滤入100mL容量瓶中,以蒸馏水定容。
注意:消解时,高氯酸遇有机物时有爆炸危险,故需加足量硝酸破坏样品中的有机物。消解操作应在通风柜中进行。
6.2 校准曲线的绘制
在6只100mL容量瓶中,依次加入0.50,1.00,2.00,3.00,4.00,5.00mL中间标准铜溶液,用1+499硝酸定容,此溶液中铜的浓度依次为5.0,10.0,20.0,30.0,40.0,50.0μg/L。
依次进样20μL,分别测定吸光度A,以A为纵坐标,铜溶液浓度为横坐标作图,得校准曲线。
石墨炉工作条件(参考):
元素 分析线 干燥 灰化 原子化 清洗 清洗气体 进样体积
(nm) (℃/s) (℃/s) (℃/s) (℃/s) (μL)
Cu 324.7 120/10 900/20 2500/5 2650/5 Ar 20
6.3 样品测定
吸取20μL消解定容后的样液注入石墨中,测定吸光度Ax,从校准曲线上查出样液中铜的浓度。
7 结果处理(见附图)
样液中铜的浓度Cu=31.541μg/L
2.3化学需氧量的测定——重铬酸钾法
1 原理
在水样中加入已知量的重铬酸钾标准溶液,在强酸性介质中以银盐作催化剂,经沸腾回流后,以试亚铁灵为指示剂,用硫酸亚铁铵标准溶液回滴水样中未被还原的重铬酸钾,由消耗的重铬酸钾的量计算水样的化学需氧量(CODCr)。
在酸性重铬酸钾溶液中,芳烃及吡啶难以被氧化,其氧化率较低。在硫酸银催化作用下,直链脂肪族化合物可有效地被氧化。
2 适用范围
本法适用于各种类型的含COD值大于30mg/L的水样,对未经稀释的水样的测定上限为700mg/L。
本法不适用于含氯化物浓度大于1000mg/L(稀释后)的含盐水。
3 主要仪器
回流装置:带有24号标准磨口的250mL锥形瓶的全玻璃回流装置。回流冷凝管长度为300~500mm。若取样量在30mL以上,可采用带500mL锥形瓶的全玻璃回流装置。
加热装置。
25mL或50mL酸式滴定管。
4 试剂
除非另有说明,实验时所用试剂均为符合国家标准的分析纯试剂,试验用水均为蒸馏水或同等纯度的水。
3.1 硫酸银(Ag2SO4),化学纯。
3.2 硫酸汞(HgS04),化学纯。
3.3 硫酸(H2SO4),ρ=1.84g/mL。
3.4 硫酸银-硫酸试剂:向250ml硫酸(3.3)中加入2.5g硫酸银(3.1).放置1—2天使之溶解,并混匀,使用前小心摇动。(m(纸)=1.0548、m(纸+硫酸银)=3.5548)
3.5 重铬酸钾标准溶液:
3.5.1 浓度为c(1/6K2Cr2O7)=0.250mol/L的重铬酸钾标准溶液:将3.0625g在105℃干燥2h后的重铬酸钾溶于水中,稀释至250mL。(m(烧杯)=24.2944、m(烧杯+重铬酸钾)=27.3570)
3.5.2 浓度为c(1/6K2Cr2O7)=0.0250mo1/L的重铬酸钾标准溶液:将3.5.1条的溶液稀释10倍而成。
3.6 硫酸亚铁铵标准溶液
3.6.1 浓度为c[(NH4)2Fe(SO4)2·6H2O]≈0.10mo1/L的硫酸亚铁铵标准溶液;溶解19.5259g硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O于水中,加入20mL硫酸(3.3),待其溶液冷却后稀释至500mL。
每日临用前,必须用重铬酸钾标准溶液(3.5.1)准确标定此溶液(3.6.1)的浓度。
取10.00mL重铬酸钾标准溶液(3.5.1)置于锥形瓶中,用水稀释至约100mL,加入30mL硫酸(3.3),混匀,冷却后,加3滴(约0.15mL)试亚铁灵指示剂(3.7),用硫酸亚铁铵(3.6.1)滴定溶液的颜色由黄色经蓝绿色变为红褐色,即为终点。记录下硫酸亚铁铵的消耗量(mL)。
3.6.2 浓度为c[(NH4)2Fe(SO4)2·6H2O]≈0.010mo1/L的硫酸亚铁铵标准滴定溶液:将3.6.1条的溶液稀释10倍,用重铬酸钾标准溶液(3.5.2)标定,其滴定步骤及浓度计算分别与3.6.1类同。
3.7 邻苯二甲酸氢钾标准溶液,c(KC6H5O4)=2.0824mmo1/L:称取105℃时干燥2h的邻苯二甲酸氢钾(HOOCC6H4COOK)0.4251g溶于水,并稀释至1000mL,混匀。以重铬酸钾为氧化剂,将邻苯二甲酸氢钾完全氧化的COD值为1.1768氧/克(指1g邻苯二甲酸氢钾耗氧1.176g)故该标准溶液的理论COD值为500mg/L。
3.8 试亚铁灵指示剂溶液:溶解0.7g七水合硫酸亚铁(FeSO4·7H2O)于50mL的水中,加入1.5g 1,10-邻二氮菲(1,10-phenanathroline monohy drate),搅动至溶解,加水稀释至100mL。
3.9 防爆沸玻璃珠。
5 样品的采集
5.1 采样
水样要采集于玻璃瓶中,应尽快分析。如不能立即分析时,应加入硫酸(3.3)至pH<2,置4℃下保存。但保存时间不多于5天。采集水样的体积不得少于100mL。
5.2 试料
将试样充分摇匀,取出20.0mL作为试料。
6 测定步骤
6.1 对于COD值小于50mg/L的水样,应采用低浓度的重铬酸钾标准溶液(3.5.2)氧化,加热回流以后,采用低浓度的硫酸亚铁铵标准溶液(3.6.2)回滴。
6.2 该方法对未经稀释的水样其测定上限为700mg/L,超过此限时必须经稀释后测定。
6.3 对于污染严重的水样。可选取所需体积1/10的试料和1/10的试剂,放入10×150mm硬质玻璃管中,摇匀后,用酒精灯加热至沸数分钟,观察溶液是否变成蓝绿色。如呈蓝绿色,应再适当少取试料,重复以上试验,直至溶液不变蓝绿色为止。从而确定待测水样适当的稀释倍数。
6.4 取试料(5.2)于锥形瓶中,或取适量试料加水至20.0mL。
6.5 空白试验:按相同步骤以20.0mL水代替试料进行空白试验,其余试剂和试料测定(6.8)相同,记录下空白滴定时消耗硫酸亚铁铵标准溶液的体积V1(mL)。
6.6 校核试验:按测定试料(6.8)提供的方法分析20.0mL邻苯二甲酸氢钾标准溶液(3.7)的COD值,用以检验操作技术及试剂纯度。
该溶液的理论COD值为500mg/L,如果校核试验的结果大于该值的96%,即可认为实验步骤基本上是适宜的,否则,必须寻找失败的原因,重复实验,使之达到要求。
6.7 去干扰试验:无机还原性物质如亚硝酸盐、硫化物及二价铁盐将使结果增加,将其需氧量作为水样COD值的一部分是可以接受的。
该实验的主要干扰物为氯化物,可加入硫酸汞(4.2)部分地除去,经回流后,氯离子可与硫酸汞结合成可溶性的氯汞络合物。
当氯离子含量超过1000mg/L时,COD的最低允许值为250mg/L,低于此值结果的准确度就不可靠。
6.8 水样的测定:于试料(6.4)中加入10.0mL重铬酸钾标准溶液(3.5.1)和几颗防爆沸玻璃珠(3.9),摇匀。
将锥形瓶接到回流装置冷凝管下端,接通冷凝水。从冷凝管上端缓慢加入30mL硫酸银-硫酸试剂(3.4),以防止低沸点有机物的逸出,不断旋动锥形瓶使之混合均匀。自溶液开始沸腾起回流两小时。
冷却后,用20-30mL水自冷凝管上端冲洗冷凝管后,取下锥形瓶,再用水稀释至140mL左右。
溶液冷却至室温后,加入3滴1,10-菲罗啉指示剂溶液(3.8),用硫酸亚铁铵标准滴定溶液(3.6)滴定,溶液的颜色由黄色经蓝绿色变为红褐色即为终点。记下硫酸亚铁铵标准滴定溶液的消耗毫升数V2。
6.9 在特殊情况下,需要测定的试料在10.0mL到50.0mL之间,试剂的体积或重量要按表1作相应的调整。
表1 不同取样量采用的试剂用量
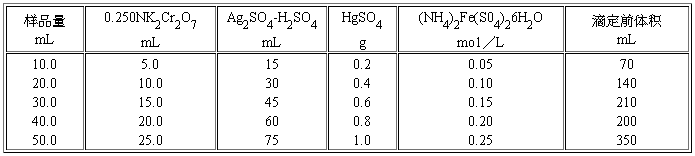
7 实验数据记录及处理
硫酸亚铁铵标准溶液浓度的计算:
c[(NH4)2Fe(SO4)2·6H2O]=c(1/6K2Cr2O7)V(1/6K2Cr2O7)/V
式中:V--滴定时消耗硫酸亚铁铵溶液的体积,mL。
1. 滴定浓度为c[(NH4)2Fe(SO4)2·6H2O]≈0.10mo1/L的硫酸亚铁铵标准溶液
硫酸亚铁铵的消耗量V(mL)=24.60 mL
则滴定后浓度c[(NH4)2Fe(SO4)2·6H2O]=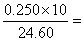 0.1016 mg/L
0.1016 mg/L
2. 滴定浓度c[(NH4)2Fe(SO4)2·6H2O]≈0.010mo1/L的硫酸亚铁铵标准溶液
硫酸亚铁铵的消耗量V(mL)=24.58 mL
则滴定后浓度c[(NH4)2Fe(SO4)2·6H2O]=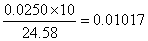 mg/L
mg/L
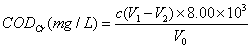
式中:CODCr——重铬酸钾法测得的水样的化学需氧量,mg/L;
c——硫酸亚铁铵标准溶液的浓度,mol/L;
V1——空白试验所消耗的硫酸亚铁铵标准溶液的体积,mL;
V2——试料测定所消耗的硫酸亚铁铵标准溶液的体积,mL;
8——1/4 O2的摩尔质量,g/mol
空白滴定时消耗硫酸亚铁铵标准溶液的体积V1(mL)=37.60 mL
校核滴定时消耗硫酸亚铁铵标准溶液的体积V2-1(mL)=16.80 mL
试料测定消耗的硫酸亚铁铵标准溶液的体积V2-2(mL)=26.80mL
邻苯二甲酸氢钾COD(mg/L)= 53 mg/L
53 mg/L
水样COD(mg/L)= =439.02 mg/L
=439.02 mg/L
查国家标准水样中的化学需氧量不小于30 mg/L,上限为700 mg/L。故邵水河水实验结果在此范围之内。
2.4水样中溶解氧的测定——碘量法
1 原理
在水样中加入MnSO4和碱性KI溶液,水中溶解氧将Mn2+氧化成四价锰沉淀,使水样中的溶解氧固定(此操作应在采样现场进行),有关反应为:
Mn2++2OH-=Mn(OH)2↓
2 Mn(OH)2+O2=2 MnO(OH)2↓(棕色)
水样送达实验室后,向水样中加浓硫酸,使沉淀溶解,四价锰将I-氧化成I2,以淀粉为指示剂,用硫代硫酸钠标准溶液滴定析出的I2。有关反应为:
MnO(OH)2+2I-+4H+=Mn2++I2+3H2O
I2+2S2O32-=S4O62-+2I-
2 主要仪器
250~300mL溶解氧瓶。
3 试剂
除非另有说明,实验时所用试剂均为符合国家标准的分析纯试剂,试验用水均为蒸馏水或同等纯度的水。
3.1 硫酸锰溶液:480g MnSO4·4H2O溶于水,稀释至1000mL。此溶液加至酸化过KI溶液中,遇淀粉不得显蓝色。
3.2 碱性碘化钾溶液:500gNaOH溶于300~400mL水中,冷却至室温;另取150gKI溶于200mL水中。将两液合并,混匀,用蒸馏水稀释至1000mL。贮于棕色瓶中,用橡皮塞塞紧,避光保存。此溶液酸化后,遇淀粉应不显蓝色。
3.3 1+5硫酸。
3.4 1%淀粉溶液:1g可溶性淀粉,以少量水调成糊状后,用沸蒸馏水冲稀至100mL,冷却后加0.1g水杨酸或0.4g氯化锌防腐。
3.5 0.02500mol/L 1/6K2Cr2O7标准溶液:准确称取于105~110℃烘干2h并冷却的K2Cr2O7(基准)1.2258g,溶于蒸馏水,并定容至1000mL,摇匀。
3.6 硫代硫酸钠标准溶液:62g Na2S2O3·5H2O,溶于刚煮沸放冷的蒸馏水中,加0.2g碳酸钠,用蒸馏水稀释至1L,贮于棕色瓶中。
标定方法:于250mL锥形瓶中,加入100mL蒸馏水,1gKI,10.00mL 0.02500mol/L 1/6K2Cr2O7标准溶液,5mL(1+5)H2SO4,摇匀,暗处静置5min,用等标定的硫代硫酸钠溶液滴定至淡黄色,加1mL1%淀粉指示剂,继续滴定至蓝色刚好消失为终点。
3.7 硫酸。
4 样品的采集
用溶解氧瓶瓶采集样品,采样时要注意不使水样曝气或有气泡残存在采样瓶中,可用水样冲洗溶解瓶后,沿瓶壁直接倾注水样或用虹吸法将细管插入溶解氧瓶底部,注入水样至溢流出瓶容积的8倍以上。
在取样现场用吸量管插入溶解氧瓶的液面下,加入1mL硫酸锰,2mL碱性碘化钾溶液,小心盖好瓶塞(瓶内不得残存气泡),颠倒混合数次,静置。待棕色沉淀物降至瓶内一半时,再颠倒混合1次,待瓶内沉淀物下降到瓶底。固定后的水样应保存在暗处,同时记录水温和大气压。
5 测定步骤
轻轻打开瓶塞,立即用吸量管插入液面下加入2.0mL浓硫酸,小心盖好瓶塞,颠倒混合摇匀,至沉淀物全部溶解,暗处放置5min。
吸取100.0mL上述溶液于250mL锥形瓶中,用硫代硫酸钠标准溶液滴定至淡黄色,加1mL1%淀粉指示剂,继续滴定至蓝色刚好消失为终点,记录消耗的硫代硫酸钠标准溶液体积。
6 实验数据记录及处理
水温 10.3℃ 大气压 99.95kPa
c(Na2S2O3) = 0.02500 .00/V mol/L
.00/V mol/L
式中V为滴定时消耗的硫代硫酸钠溶液体积,mL。
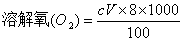 mg/L
mg/L
式中:c——硫代硫酸钠标准溶液浓度,mol/L;
V——滴定时消耗的硫代硫酸钠标准溶液体积,mL。
1.未稀释滴定时消耗的硫代硫酸钠溶液体积V(mL)=1.23 mL
c(Na2S2O3) =0.02500 .00/1.23=0.2033 mol/L
.00/1.23=0.2033 mol/L
水样滴定时消耗的硫代硫酸钠标准溶液体积V(mL)=0.78 mL
溶解氧=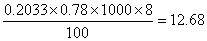 mg/L
mg/L
2.稀释滴定时消耗的硫代硫酸钠溶液体积V(mL)=10.20 mL
c(Na2S2O3) =0.02500 .00/10.20=0.02451 mol/L
.00/10.20=0.02451 mol/L
水样滴定时消耗的硫代硫酸钠标准溶液体积V(mL)=7.48mL
溶解氧=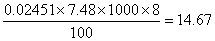 mg/L
mg/L
查水样中的溶解氧的国家标准为:0.2-20 mg/L,故该水样在国家的标准范围以内。
3.实习收获和重要心得体会
通过本课程的学习,进一步巩固和加深了对分析化学基础理论,学会了分析、解决在实习过程中出现的一些具体问题,培养和提高了实验基本技能技巧,培养了严谨的实验作风、实事求是的科学态度和相互协作的团队精神,,为培养创新意识和创新能力,学习后续课程和未来从事科学研究及实际工作打下良好的基础。
实验过程中我懂得了团体合作的重要性,学会了对待任何一件事情都必须谨慎认真,也学会了石墨炉原子吸收分光光度法测量的一些必须项目。同时也接触到了一些新的仪器如具塞比色管。课程实习巩固了我们对有关仪器的一些操作方法如分析天平的使用、720分光光度计的使用以及熟练溶液的配制、定容操作和准确的滴定操作。
在整个实验的研究和撰写过程中,始终得到指导老师夏湘老师的精心指导,在此表示我最真诚的谢意。同时在实验室里苑春歌、刘田英、陈清烨、谭周、颜家林等同学也给我提供了帮助及宝贵意见。
4.存在不足
1、在实习过程中,由于对试验原理不熟悉,导致时间分配出现一点小问题。
2、实验操作不过规范,容量瓶、移液管、滴定操作等不是很熟练,需加强这方面的训练。
3、加强团队合作,努力配合各组员的工作,力求实验过程的严谨。

