盐类水解知识点总结(附带例题)
答:同学,你好!为你归纳重点内容供参考:
盐类的水解
【知识点精讲】
一、盐类水解的实质
 盐电离出来的某些离子(一般是弱酸根离子或弱碱阳离子)跟水电离出来的H+或OH-结合生成了弱电解质,促使水的电离平衡发生移动,结果溶液中c(H+)、c(OH-)发生了相对改变,从而使溶液呈一定的酸碱性。
盐电离出来的某些离子(一般是弱酸根离子或弱碱阳离子)跟水电离出来的H+或OH-结合生成了弱电解质,促使水的电离平衡发生移动,结果溶液中c(H+)、c(OH-)发生了相对改变,从而使溶液呈一定的酸碱性。
盐类的水解程度一般都很小,且是可逆反应,书写水解方程式时要用“ ”表示。因水解是微弱的,平衡时生成的弱电解很少,所以一般不会产生沉淀和气体,生成物不应加沉淀符号(↓)或气体符号(↑)。
二、盐类水解的类型和规律
1、强碱弱酸盐水解,溶液呈碱性,pH>7,如CH3COONa、NaCO3等。
多元弱酸根离子是分步水解的,且第一步水解程度>>第二步水解程度,溶液的酸碱性主要决定于第一步水解程度。如Na2CO3在水溶液中水解应分两步写:
①CO32-+H2O HCO3-+OH-,②HCO3-+H2O
HCO3-+OH-,②HCO3-+H2O H2CO3+OH-
H2CO3+OH-
多元弱酸的酸式根离子同时具备电离和水解两种趋势:HR- H++R2-(电离,呈酸性),HR-+H2O
H++R2-(电离,呈酸性),HR-+H2O H2R+OH-(水解,呈碱性),这需要具体分析。很显然如果电离趋势占优势,则显酸性,如:H2PO4-、HSO3-,如果水解趋势占优势,则显碱性,如:HCO3-、HS-、HPO42-等。
H2R+OH-(水解,呈碱性),这需要具体分析。很显然如果电离趋势占优势,则显酸性,如:H2PO4-、HSO3-,如果水解趋势占优势,则显碱性,如:HCO3-、HS-、HPO42-等。
2、强酸弱碱盐水解,溶液呈酸性,pH<7,如NH4Cl、Al2(SO4)3等。
3、强酸强碱盐不水解,溶液呈中性,pH=7,如NaCl、KNO3等。
4、弱酸弱碱盐水解,溶液呈什么性由水解生成的弱酸、弱碱的相对强弱比较来决定。
当遇到某些弱酸弱碱盐两种离子都发生水解,应在同一离子方程式中表示,而且因强烈水解,若是水解产物中有气体或难溶物质或易分解物质的话,这类水解往往能进行到底,这样水解方程式应用“=”号表示,并在生成的沉淀和气体的后面标上“↓”或“↑”。如2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。
三、影响盐类水解的因素
1、盐类本身的性质 这是影响盐类水解的内在因素。组成盐的酸或碱越弱,盐的水解程度越大,其盐溶液的酸性或碱性就越强。
2、温度 由于盐的水解作用是中和反应的逆反应,所以盐的水解是吸热反应,温度升高,水解程度增大。
3、浓度 盐的浓度越小,则水解程度越大。
4、溶液的酸碱性 盐类水解后,溶液会呈现不同的酸碱性。因此,控制溶液的酸碱性可以促进或抑制盐的水解。如在配制FeCl3溶液时常加入少量盐酸来抑制FeCl3水解。
四、盐类水解的应用

【例题选讲】
例1、浓度为0.1mol/L的八种溶液:①HNO3②H2SO4③CH3COOH ④Ba(OH)2⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl ,其pH值由小到大的顺序为。
分析:以上八种溶液浓度相同,所以可按下列顺序进行排列:多元强酸、一元强酸、一元弱酸、水解后显酸性的盐溶液,水解后显中性的盐溶液或不水解的正盐溶液、水解后显碱性的盐溶液、一元弱碱、一元强碱、多元强碱。
答案:②①③⑧⑦⑥⑤④
例2、室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液中,设由水电离产生的OH-的物质的量溶液分别为Amol/L和Bmol/L,则A和B的关系为。
分析:水的电离平衡为H2O H++OH-。在NaOH溶液中,由于加入了OH-离子,水的电离平衡向逆反应方向移动,c(H+)减少;在pH=9的NaOH溶液中,c(H+)=10-9mol/L,这些H+全部是水电离子产生出来的;因为c(OH+)水=c(OH-)水,所以由水电离产生的OH-离子浓度A=10-9mol/L。在CH3COONa溶液中,由于CH3COO-离子结合了水中的H+离子,水的电离平衡向正反应方向移动,c(OH-)增大;在pH=9的CH3COONa溶液中,c(OH-)=
H++OH-。在NaOH溶液中,由于加入了OH-离子,水的电离平衡向逆反应方向移动,c(H+)减少;在pH=9的NaOH溶液中,c(H+)=10-9mol/L,这些H+全部是水电离子产生出来的;因为c(OH+)水=c(OH-)水,所以由水电离产生的OH-离子浓度A=10-9mol/L。在CH3COONa溶液中,由于CH3COO-离子结合了水中的H+离子,水的电离平衡向正反应方向移动,c(OH-)增大;在pH=9的CH3COONa溶液中,c(OH-)=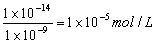 ,这些OH-全部是水电离产生的,即B=10-5mol/L,所以,A:B=10-9:10-5=10-4:1。
,这些OH-全部是水电离产生的,即B=10-5mol/L,所以,A:B=10-9:10-5=10-4:1。
答案:A:B=10-4:1
例3、在硫化钠水溶液中存在着多种离子和分子,下列关系式正确的是( )
A、c(OH-)=c(HS-)+c(H+)+c(H2S)
B、c(OH-)=c(HS-)+c(H+)+2c(H2S)
C、c(Na+)=c(S2-)+c(HS-)+c(H2S)
D、c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
分析:首先确定溶液中有哪些离子。在硫化钠水溶液中存在下列平衡:
H2O+S2- HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O H2S+OH-,H2O
H2S+OH-,H2O H++OH-。据电荷平衡:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),据物料平衡:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)。由上述两个平衡可知:c(OH-)=c(HS-)+c(H+)+2c(H2S),故选B、D。
H++OH-。据电荷平衡:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),据物料平衡:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)。由上述两个平衡可知:c(OH-)=c(HS-)+c(H+)+2c(H2S),故选B、D。
答案:B、D。
【同步练习】
一、选择题:(每题有1-2个正确答案)
1、下列各物质投入水中,因促进水的电离而使溶液呈酸性的是( )
A、NaHSO4B、Na3PO4C、CH3COOH D、Al2(SO4)3
2、物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A、HX、HY、HZ B、HZ、HY、HX C、HX、HZ、HY D、HY、HZ、HX
3、将滴有甲基橙的醋酸钠饱和溶液加热,溶液的颜色是( )
A、黄色不变 B、黄色变橙色 C、黄色变红色 D、橙色不变
4、下列关于盐类水解的叙述中,错误的是( )
A、盐类水解是中和反应的逆反应
B、盐类水解过程是吸热过程
C、含有弱酸根盐的水溶液一定显碱性
D、盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱
5、下列各组离子中能在溶液中大量共存,且溶液呈碱性透明的是( )
A、Na+、OH-、H2PO4-、NO3-B、AlO2-、K+、CO32-、Na+
C、Al3+、Cl-、AlO2-、Na+D、Fe2+、K+、H+、NO3-
6、用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)大于c(Na+)。对该混合溶液的下列判断正确的是( )
A、c(H+)>c(OH-)
B、c(CH3COOH)+c(CH3COO-)=0.2mol/L
C、c(CH3COOH)>c(CH3COO-)
D、c(CH3COO-)+c(OH-)=0.2mol/L
7、100mLpH=11的氨水与100mLpH=3的盐酸相混合,所得的混合液( )
A、显碱性 B、显酸性
C、显中性 D、不能确定其酸碱性
8、物质的量浓度相同的下列溶液:①Na2CO3②NaHCO3③H2CO3④(NH4)2CO3⑤NH4HCO3,按c(CO32-)由小到大排列顺序正确的是( )
A、⑤<④<③<②<① B、③<⑤<②<④<①
C、③<②<⑤<④<① D、③<⑤<④<②<①
9、为了使Na2S溶液中c(Na+)/c(S2-)的比值变小,可加入的物质是( )
A、适量盐酸 B、适量NaOH C、适量KOH D、适量KHS
10、将0.1mol下列物质置于1L水中充分搅拌后,溶液中阴离子数最多的是( )
A、KCl B、Mg(OH)2C、Na2CO3D、MgSO4
二、填空题:
11、写出下列盐溶液水解的离子方程。
(1)(NH4)2SO4:;
(2)AlCl3:;
(3)KF:;
(4)Na3PO4:;
12、现有S2-、SO32-、NH4+、Al3+、HPO42-、Na+、SO42-、AlO2-、Fe3+、HCO3-、Cl-等离子,请按要求填空:
(1)在水溶液中,该离子水解呈碱性的是。
(2)在水溶液中,该离子水解呈酸性的是。
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有。
(4)既不能在酸性较强的溶液里大量存在,又不能在碱性较强的溶液里大量存在的离子有。
13、泡沫灭火剂的原理是(写离子方程式),其中小苏打溶液放在筒,Al2(SO4)3溶液放在筒,原因是。
14、实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是;配制完毕后要加入少量铁屑,其目的是。
15、把AlCl3溶液蒸干灼烧,最后得到的主要固体产物是,为什么?(用化学方程式和必要的文字说明)。
16、25℃时将0.01mol的CH3COONa和0.002mol的HCl溶于水中形成混合溶液,请将溶液中存在的各种离子、分子按数目多少的顺序排列;混合溶液中CH3COO-和OH-两种微粒的物质的量之和比H+多mol。
17、某二元弱酸(简写为H2A)溶液,按下式发生一级或二级电离:
H2A H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-
已知相同浓度时的电离度2(H2A)>2(HA-),设有下列四种溶液:
A、0.01mol/L的H2A溶液
B、0.01mol/L的NaHA溶液
C、0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D、0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合
据此,填写下列空白(填代号):
(1)c(H+)最大的是,最小的是。
(2)c(H2A)最大的是,最小的是。
(3)c(A2-)最大的是,最小的是。
【参考答案】
一、1、D 2、A 3、A 4、C 5、B
6、A、B 7、A 8、B 9、C、D 10、C
二、11、(1)NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(2)Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
(3)F-+H2O HF+OH-
HF+OH-
(4)PO43-+H2O HPO42-+OH-,HPO42-+H2O
HPO42-+OH-,HPO42-+H2O H2PO4-+OH-
H2PO4-+OH-
H2PO4-+H2O H3PO4+OH-
H3PO4+OH-
12、(1)S2-、SO32-、HPO42-、AlO2-、HCO3-(2)NH4+、Al3+、Fe3+
(3)Na+、SO42-、Cl-(4)HPO42-、HCO3-
13、Al3++3HCO3-=Al(OH)3↓+3CO2↑ 外 内 因为Al2(SO4)3水解而致使溶液呈酸性,若放在铁制外筒中,会反应生成H2。
14、为了抑制Fe2+的水解 防止Fe2+被空气中的氧气氧化成Fe3+
15、Al2O3因为AlCl3是挥发性酸所形成的铝盐,加热促进AlCl3水解,以致完全得到Al(OH)3,HCl则挥发掉:AlCl3+3H2O Al(OH)3↓+3HCl↑,高温下,可使Al(OH)3分解,2Al(OH)3
Al(OH)3↓+3HCl↑,高温下,可使Al(OH)3分解,2Al(OH)3 Al2O3+3H2O,固体产物为Al2O3。
Al2O3+3H2O,固体产物为Al2O3。
16、Na+>CH3COO->Cl->CH3COOH>H+>OH-0.008
17、(1)A、D (2)C、D (3)D、A
第二篇:盐类的水解知识点(学生版)
【盐类的水解知识大复习】
一、探究盐溶液的酸碱性
结论:强酸弱碱盐显酸性,强碱弱酸盐显碱性,强酸强碱盐显中性。
二、盐溶液呈现不同酸碱性的原因
三、盐的水解原理
1.定义:在溶液中,盐电离出来的阴离子或阳离子与水所电离出来的H+或OH-结合生成弱电解质,这种作用叫做盐类的水解。
2.实质及结果
实质:促进水的电离平衡。
结果:盐的溶液呈现出不同程度的酸、碱性。
3.水解条件
a.盐必须溶于水中
b.生成盐的酸或碱是弱酸或弱碱(有弱才水解,无弱不水解,都弱双水解)
4.水解特征
水解是微弱、可逆的,用可逆符号“ ”
”
【小结】水解规律:
有弱才水解,无弱不水解,都弱双水解,谁强显谁性,都强显中性
5 盐溶液中水的电离规律
【例题】1、pH=3的HCl和pH=11的NaOH溶液中由水电离出来的c(H+)水
2、pH=3的NH4Cl和pH=11的CH3COONa溶液中由水电离出来的c(H+)水
【小结】盐溶液中水的电离有如下规律:
a.在强酸弱碱盐溶液中,盐的水解促进了水的电离,水的电离程度比纯水、酸或碱溶液(抑制水的电离)中水的电离程度大。
b.在酸或碱溶液中,c(H+)、c(OH-)中小的那一个表示水的电离;在盐溶液中,c(H+)、c(OH-)中大的那一个反映了水的电离程度。
四、水解方程式的书写
(1)判断能否水解;
(2)水解是微弱的,用可逆符号表示。通常不生成沉淀或气体,也不发生分解。在书写离子方程式时一般不标“↓”或“↑”,也不把生成物(如H2CO3、NH3·H2O等)写成其分解产物的形式;
(3)多元弱酸的盐分步水解,以第一步为主。
(4)多元弱碱盐的水解视为一步完成。
(5)双水解——不完全双水解与完全双水解
不完全水解用可逆符号,完全水解用等号表示。
五、盐类水解的影响因素
1.内因——越弱越水解(越热越水解,越稀越水解)
以醋酸钠为例:CH3COO-+H2O CH3COOH+OH-Kh
CH3COOH+OH-Kh
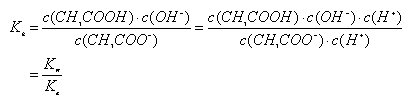
弱酸或弱碱的电离常数越(越弱),其所生成的盐水解的程度就越大。
2.外因:温度、浓度、酸or碱、盐溶液
【练习】在氨水中存在下列平衡:NH3·H2O NH4++OH-,若加入下列物质对该平衡有何影响?⑴NH4Cl固体(逆向) ⑵Na2CO3固体(逆向) ⑶FeCl3固体(正向)
NH4++OH-,若加入下列物质对该平衡有何影响?⑴NH4Cl固体(逆向) ⑵Na2CO3固体(逆向) ⑶FeCl3固体(正向)
【总结】判断溶液中平衡移动方向的一般思路:
①加入的物质是否与之反应;
②加入的物质是否与之有同离子效应;
③若前两项都不具备则考虑水解问题。
六、水解平衡的应用
(1)配置和储存易水解的盐溶液
在配制FeCl3、AlCl3、CuCl2、SnCl2等强酸弱碱盐溶液时,为防止水解,常先将盐溶于少量相应的酸中,再加蒸馏水稀释到所需浓度。
Na2SiO3、Na2CO3、NH4F等不能储存在有磨口玻璃塞的试剂瓶中。因水解呈碱性,与玻璃组成成分作用产生(一种黏合剂),将瓶塞与瓶子
(2)某些活泼金属与强酸弱碱盐反应
NH4++ H2O NH3?H2O + H+
NH3?H2O + H+
镁常温下不易与水发生反应,但镁粉放入氯化铵的水溶液中有氢气放出
(3)判断离子能否大量共存
弱碱的金属阳离子(如Al3+、Cu2+、NH4+、Fe3+等)与弱酸的酸根(如HCO3-、CO32-、SiO32-、AlO2-、F-等)在溶液中不能同时大量共存。
(4)施用化肥
长期施用(NH4)2SO4的土壤因NH4+水解而使土壤的酸性增强;草木灰(K2CO3)不能与铵态氮肥混用。
(5)判断盐溶液的酸碱性或pH
(6)判断盐溶液中粒子种类多少
(7)加热蒸干某些盐溶液制取其他产物
判断盐溶液蒸干得到什么物质主要考虑以下三个方面。
a水解:盐溶液水解生成难挥发性酸时,蒸干后一般得原溶质,如Al(SO4)2、CuSO4溶液蒸干得Al(SO4)2、CuSO4固体;盐溶液水解生成不挥发碱和弱酸时,蒸干也得到原溶质,如K2CO3、Na2S溶液蒸干得到K2CO3、Na2S固体;盐溶液水解生成易挥发性酸时,蒸干后一般得对应的弱碱,如AlCl3、FeCl3溶液蒸干后一般得Al(OH)3、Fe(OH)3。
b分解:若盐的热稳定性差,加热蒸干其溶液的过程中会发生分解而得不到原溶质,得到的是其分解产物。如Ca(HCO3)2、NaHCO3、KMnO4、NH4Cl固体受热易分解,因此蒸干Ca(HCO3)2溶液得到CaCO3固体;蒸干NaHCO3溶液得到Na2CO3固体;蒸干KMnO4溶液得到K2MnO4和MnO2的混合物;蒸干NH4Cl溶液不能得到固体。
c氧化:若盐的还原性强,加热蒸干其溶液的过程中盐可能被O2氧化而得不到原溶质,得到的是其氧化产物。如NaSO3溶液蒸干会得到Na2SO4;FeSO4溶液蒸干会得到Fe2(SO4)3和Fe(OH)3的混合物。
(8)泡沫灭火器(Al2(SO4)3、NaHCO3)
Al3++ 3HCO3-= Al(OH)3↓+3CO2↑
Al3+不与CO32-、HCO3-、AlO2-、S2-共存,Fe3+不与CO32-、HCO3-、AlO2-共存
七、判断溶液离子浓度大小
1.单盐水解:
Na2CO3c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
电荷守恒: c(Na+)+c(H+) =2c(CO32-)+c(OH-)+c(HCO3-)
物料守恒:c(Na+) = 2 [ c(CO32-) + c(HCO3-) + c(H2CO3) ]
质子守恒:c (H+) + c (HCO3-) + 2 c (H2CO3) = c (OH-)
NaHCO3c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c (CO32-)
电荷守恒:c(Na+)+c(H+) =2c(CO32-)+c(OH-)+c(HCO3-)
物料守恒:c(Na+) =[ c(CO32-) + c(HCO3-) + c(H2CO3) ]
质子守恒:c (H+) +c (H2CO3) = c (OH-) + c (CO32-)
NH4Cl c(Cl-)>c(NH4+)> c(H+) > c(OH-)
电荷守恒:c (NH4+)+c( H+) = c(Cl-) + c(OH-)
物料守恒:c (NH4+) + c(NH3·H2O) = c(Cl-)
质子守恒:c(H+) = c(OH-) + c(NH3·H2O )
2.混合液的离子浓度比较
0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,离子浓度由大到小的顺序是
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
[解析]CH3COONa、CH3COOH
c(CH3COO-) + c(CH3COOH) =2 c(Na+) =0.1mol/L
1往盐酸中加入氨水:
四种离子多种成分
a.HCl多 、NH4Cl少 c(Cl-)>c(H+)>c(NH4+)>c(OH-)
b.NH4Cl c(Cl-)>c(NH4+)>c(H+)>c(OH-)
c. NH4Cl 、NH3·H2O pH=7 c(Cl-)=c(NH4+)>c(H+)=c(OH-)
d. NH4Cl 1 NH3·H2O 1 c(NH4+)>c(Cl-)>c(OH-)> c(H+)
【小结】两种溶液混合后,离子浓度的大小的比较,首先是判断两者是否反应,确定混合溶液溶质的成分,再依据有关关系式作出判断。
【练习】
1.同浓度的下列溶液pH从小到大的顺序是
①H2SO4②Ba(OH)2③CH3COOH ④HCl ⑤NaCl ⑥NH4Cl ⑦CH3COONa
2.NH4Cl溶液和HCl稀溶液pH均为5,其中两溶液由水电离出的c(H+)分别为a和b,则a与b的正确关系是( )
A. a=b B. b>a C. b=104a D. a=104b
3.Na2CO3溶液在稀释过程中,溶液中下列那些项逐渐增大( )
A. c(H+) B. c(OH-) C. pH值 D. CO32-+H2O HCO3-+ OH-
HCO3-+ OH-
4.能将Ba(NO3)2、KCl 、Al2(SO4)3、FeCl3、CH3COOH五种溶液区别开的试剂是 ( )
A.pH试纸 B.Na2CO3C.NaOH D.NH3·H2O
5.0.2mol/LNH3·H2O溶液与0.1mol/LHCl溶液等体积混合,离子浓度由大到小的顺序是。
6.常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,溶液中c(HCOO-)与c(Na+)的关系为( )
A. c(HCOO-) > c(Na+) B. c(HCOO-) < c(Na+)
C. c(HCOO-) = c(Na+) D. 无法确定
1、用物质的量都是0.1mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-) 小于c(Na+),则下列判断中正确的是( )
A. c(H+) > c(OH-) B. c(HCN) > c(CN-) =0.2mol/L
C. c(HCN) > c(CN-) D. c(CN-) > c(OH-) =0.1mol/L
2、在Na2S的水溶液中存在着多种离子和分子,下列关系不正确的是 ( )
(A) c(OH-) = c(H+) + c(HS-) + c(H2S)
(B) c(OH-) = c(H+) + c(HS-) + 2c(H2S)
(C) c(Na+) + c(H+) = c(OH-) + 2c(S2-)+c(HS-)
(D) c(Na+) = 2c(S2-) + 2c(HS-) + 2c(H2S)
3、把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混合,混合溶液中离子浓
度关系正确的是( )
A. c(CH3COO-) > c(Na+) B. c(CH3COOH) > c(CH3COO-)
C. 2c(H+)=c(CH3COO-) - c(CH3COOH) D. c(CH3COOH)+c(CH3COO-)=0.02mol/L
4、下列离子浓度大小比较错误的是( )
A. c(Cl-)>c(NH4+)> c(H+) > c(OH-)
B. c(Cl-)>c(NH4+)> c(OH-) > c(H+)
C. c(Cl-)> c(H+) > c(NH4+) > c(OH-)
D. c(NH4+)>c(Cl-) >c(OH-) > c(H+)
5、已知某溶液中只存在OH-、H+、 Na+、 CH3COO-四种离子,若该溶液中含有两种溶质,则这四种离子浓度大小顺序可能是( )
A. c(CH3COO-)>c(Na+)>c( OH-)>c(H+) B. c(Na+)>c(CH3COO-) >c(H+) > c( OH-)
C. c(Na+)=c(CH3COO-) > c( OH-) = c(H+) D. c(Na+)>c( OH-) > c(CH3COO-) >c(H+)
6、为了配制CH3COO-与Na+离子浓度比为1:1的溶液,可向CH3COONa溶液中加入( )
A 适量盐酸 B 适量NaOH固体
C 适量KOH D 适量NaCl晶体
7、某温度(t℃)时,水的KW=10-13,则该温度(填大于、小于、或等于)__25℃,其
理由是。将此温度下pH=11的NaOH溶液amL与pH=1的H2SO4溶液bmL混合:
(1)若所得混合液为中性,则a:b=____;离子浓度按大小:___________。
(2)若所得混合液的pH=2,则a:b=_____;离子浓度按大小:____________________。
8、将0.2mol/L CH3COONa与0.1mol/LHCl等体积混合后,溶液中下列微粒的物质的量浓度关系正确的是( )
A [CH3COO-]=[Cl-]=[H+]>[CH3COOH] B [CH3COO-]=[Cl-]>[CH3COOH] >[H+]
C [CH3COO-]>[Cl-]>[H+]>[CH3COOH] D [CH3COO-]>[Cl-]>[CH3COOH]>[H+]
9、在水电离出的c(H+)=10-14mol/L的溶液中,一定能大量共存的离子组是( )
A .K+Fe2+SO32-MnO4-B. Na+Cl-NO3-SO42-
C .Al3+NH4+Cl-SO42-D. Na+AlO2-Br-Cl-
10、0.1mol/L的NaHS溶液中有关微粒浓度的关系,正确的是( )
A .[Na+]>[HS-]>[S2-]>[H+]>[OH-] B. [Na+]>[HS-]>[OH-]>[S2-]
C.[Na+]=[HS-]+2[S2-]+[OH-] D. [Na+]=[H2S]+[HS-]+[S2-]
11、常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
A.该溶液中由水电离出的c(H+)=1×10-3mol·L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中
2c(H+)+c(HA)=c(A-)+2c(OH-)
12、在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是( )
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH一)
C.c(Na+) >c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
13、下列溶液中微粒的物质的量浓度关系正确的是 ( )
A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B.0.1 mol·L-1的 NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
C.Na2CO3溶液:c(OH-)—c(H+)=c(HCO3-)+2c(H2CO3)
D.25℃,pH =4.75、浓度均为0.1 mol·L-1的 CH3COOH、CH3COONa混合溶液:
c(CH3COO-)+c(OH-) <c(CH3COOH) +c(H+)
14、把AlCl3溶液蒸干灼烧,最后的得到主要固体产物是什么?为什么?(用化学方程式表示),并配以必要的文字说明。
15. 为了防止配制FeCl3溶液时可能浑浊,应向溶液中加入_______抑制______水解。Mg粉投入NH4Cl溶液中反应的离子方程式:;
泡沫灭火器原理(离子方程式)_____________
16.草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是(D)
A V(NaOH)=0时,c(H+)=1×10—2mol/L
B V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+ c(HC2O4-)
C V(NaOH)=10 mL时,c(H+)=1×10-7mol/L
D V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)

