中国石油大学(华东)现代远程教育
实验报告
课程名称:物理化学
实验名称:恒温槽调节及影响恒温槽灵敏度
因素考察
实验形式:在线模拟+现场实践
提交形式:在线提交实验报告
学生姓名:李展雄学号:12482380035
年级专业层次:高起专
学习中心:广东梅州梅江奥鹏学习中心[15]
提交时间:20##年11月1日

备注:该报告纳入考核,占总评成绩的10%。
第二篇:物化实验报告
实验一 粘度法测定高聚物的相对摩尔质量
一、实验目的:
1、掌握乌氏粘度计测量粘度的原理和方法。
2、掌握粘度法测定聚乙烯分子量的原理、过程和数据处理方法。
二、实验原理:
由于高聚物的分子质量大小不一、参差不齐,且没有一个确定的值,故实验测定某一高聚物的分子质量实际为分子质量的平均值,称为平均分子质量(即平均摩尔质量)。根据测定原理和平均值计算方法上的不同,常分为数均分子质量、质均分子质量、Z均分子质量和粘均分子质量。
对于同一聚合物,其测得的数均、质均、Z均或粘均分子质量在数值上往往不同。人们常用渗透压、光散射及超离心沉降平衡等法测得分子质量的绝对值。粘度法能测出分子质量的相对值,但因其设备简单,操作方便,并有很好的实验精度,故是人们所常用的方法之一。
粘度是液体流动时内摩擦力大小的反映。纯溶剂粘度反映了溶剂分子间内摩擦效应之总和;而高聚物溶液粘度η是高聚物分子之间的内摩擦、高聚物分子与溶剂分子间内摩擦以及溶剂分子间内摩擦三者总和。因此,通常高聚物溶液的粘度η大于纯溶剂粘度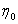 ,即η>
,即η>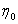 。为了比较这两种粘度,引入增比粘度的概念,以
。为了比较这两种粘度,引入增比粘度的概念,以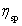 表示:
表示:
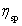 =
=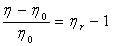 (3-1)
(3-1)
式中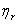 为相对粘度,
为相对粘度,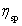 表示已扣除了溶剂分子间内外摩擦效应,只留下溶剂分子与高聚物分子之间、高聚物分子相互间的内摩擦效应,其值随高聚物浓度而变。
表示已扣除了溶剂分子间内外摩擦效应,只留下溶剂分子与高聚物分子之间、高聚物分子相互间的内摩擦效应,其值随高聚物浓度而变。
Huggins(1941年)和Kraemer(1983年)分别找出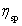 /C(称为比浓粘度)以及ln
/C(称为比浓粘度)以及ln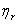 /C(称为比浓对数粘度)与溶液浓度的关系:
/C(称为比浓对数粘度)与溶液浓度的关系:
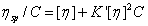 (3-2)
(3-2)
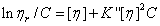 (3-3)
(3-3)
实验发现:对同一高聚物,两直线方程外推所得截距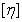 交于一点;常数
交于一点;常数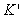 为正值,
为正值,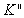 一般为负值,且两者之差约为0.5;
一般为负值,且两者之差约为0.5; 值是与高聚物分子质量有关的量,并称之为特征粘度。
值是与高聚物分子质量有关的量,并称之为特征粘度。
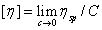 (3-4)
(3-4)
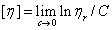 (3-5)
(3-5)
可见,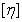 反映了在无限稀溶液中溶剂分子与高聚物分子间的内外摩擦效应,它不仅与溶剂的性质,而且与高聚物的形态和大小有关。
反映了在无限稀溶液中溶剂分子与高聚物分子间的内外摩擦效应,它不仅与溶剂的性质,而且与高聚物的形态和大小有关。
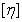 的单位是浓度的倒数,它的数值随溶液浓度的表示法不同而异。本实验的浓度用100mL溶液中所含高聚物分子的克数作为浓度的单位。
的单位是浓度的倒数,它的数值随溶液浓度的表示法不同而异。本实验的浓度用100mL溶液中所含高聚物分子的克数作为浓度的单位。
常用于描述高聚物分子质量与特征粘度的关系式是Mark经验式:
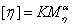 (3-6)
(3-6)
式中: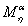 是粘均分子量;K和
是粘均分子量;K和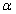 是与温度、高聚物及溶剂性质有关的常数。K值对温度较敏感,
是与温度、高聚物及溶剂性质有关的常数。K值对温度较敏感,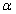 值主要取决于高聚物分子线团在溶剂中的舒展程度。在良性溶剂中,高聚物分子呈线性伸展,与溶剂摩擦机会增加,
值主要取决于高聚物分子线团在溶剂中的舒展程度。在良性溶剂中,高聚物分子呈线性伸展,与溶剂摩擦机会增加,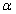 值变大;反之,在不良溶剂中,
值变大;反之,在不良溶剂中, 值小。
值小。 值一般在0.5~1之间,而K、
值一般在0.5~1之间,而K、 的具体数值只能通过诸如渗透压、光散射等的绝对方法确定,现将常用的几种高聚物——溶剂体系的数值列于下表。
的具体数值只能通过诸如渗透压、光散射等的绝对方法确定,现将常用的几种高聚物——溶剂体系的数值列于下表。
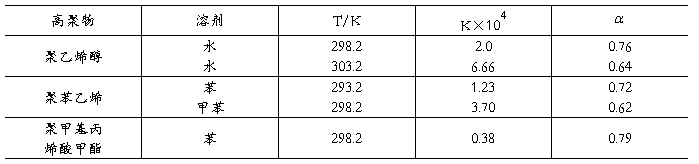
因在良性溶剂中,温度对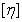 的影响不很显著,因此,如果测定时的温度与上表指定的温度有所不同,K和
的影响不很显著,因此,如果测定时的温度与上表指定的温度有所不同,K和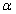 值亦可近似适用。
值亦可近似适用。
至此可知:高聚物的相对摩尔质量的测定最后归结为溶液特征粘度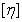 的测定。
的测定。
液体粘度的测定方法有三类:落球法、转筒法和毛细管法。前两种适用于高中粘度的测定,毛细管法适用于较低粘度的测定。本实验采用毛细管法。
当溶液在重力作用下流经毛细管粘度计时,根据Poiseuille近似公式:
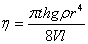 (3-7)
(3-7)
式中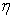 —液体粘度,
—液体粘度,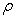 —液体密度,l和r —毛细管长度和半径,t—体积为V的液体流经毛细管的时间,h—液体流经毛细管液体的平均液柱高度,g—重力加速度。对某一指定毛细管粘度计,其r 、h、l和V均为定值,则式(3-7)可改定写为:
—液体密度,l和r —毛细管长度和半径,t—体积为V的液体流经毛细管的时间,h—液体流经毛细管液体的平均液柱高度,g—重力加速度。对某一指定毛细管粘度计,其r 、h、l和V均为定值,则式(3-7)可改定写为:
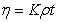 (3-8)
(3-8)
式中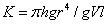 。通常是在稀溶液中测定高聚物的粘度,故溶液的密度与溶剂的密度近似相等,则溶液的相对粘度可表示为:
。通常是在稀溶液中测定高聚物的粘度,故溶液的密度与溶剂的密度近似相等,则溶液的相对粘度可表示为:
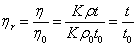 (3-9)
(3-9)
式中t和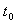 分别为溶液和纯溶剂的流出时间。
分别为溶液和纯溶剂的流出时间。
实验中,只要测出不同浓度下高聚物的相对粘度,即可求得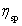 、
、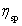 /C和ln
/C和ln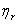 /C。作
/C。作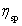 /C对C和ln
/C对C和ln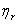 /C对C图,外推至C=0时可得
/C对C图,外推至C=0时可得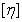 (如图3-1所示)。在已知K、
(如图3-1所示)。在已知K、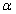 值条件下,可由式(3-6)计算出高聚物的相对摩尔质量。
值条件下,可由式(3-6)计算出高聚物的相对摩尔质量。
三、仪器和药品:
仪器和材料:恒温装置一套,乌氏粘度计,5mL、10mL移液管 各2支;洗耳球;秒表;100mL容量瓶1只;100mL烧杯1只;3号砂芯漏斗1只;100mL有塞锥形瓶11只;
药品:聚乙烯醇(A.R.);正丁醇(A.R.);无水乙醇(A.R.)。
四、实验步骤:
1.聚乙烯醇溶液的配制
准确称取聚乙烯醇0.500g于烧杯中,加60mL蒸馏水,稍加热使之溶解。待冷却至室温后,转移至100mL容量瓶中,加入0.25~0.3mL 正丁醇(消泡剂)。在298.2K 恒温约10min,加水稀释至100mL,如溶液浑浊则用3号砂芯漏斗过滤后待用。
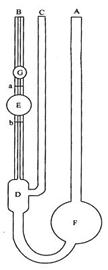 2.安装粘度计
2.安装粘度计
图3-1 乌氏粘度计
所用粘度计必须洁净,有时微量的灰尘、油污等会产生局部的堵塞现象,影响溶液在毛细管中的流速,而导致较大的误差。所以在做实验前,应彻底洗净,并放在烘箱中干燥。本实验采取乌氏粘度计, 它的最大优点是溶液的体积对测定没有影响,所以可以在粘度计内采取逐渐稀释的方法,得到的不同浓度的溶液。
在侧管C上端套一软胶管,并用夹子夹紧使之不漏气。调节恒温槽至25.00±0.05℃。把粘度计垂直放入恒温槽中,使G球完全浸没在水中,放置位置要合适,以便于观察液体的流动情况。恒温槽的搅拌马达的搅拌速度应调节合适,不致产生剧烈震动,影响测定的结果。
3.溶剂流出时间t0的测定
用移液管取10mL已恒温的蒸馏水,由A注入粘度计中。待恒温5分钟后,利用吸球由B处将溶剂经毛细管吸入球E和球G中(注意:不要过快,以免溶剂吸入吸球!),然后除去吸球使管B与大气相通并打开侧管C之夹子,让溶剂依靠重力自由流下。记录液面从a到b标线所用的时间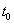 ,重复三次(任意两次时间差不得超过0.2s),取其平均值。
,重复三次(任意两次时间差不得超过0.2s),取其平均值。
4.溶液流出时间t的测定
在原10mL蒸馏水中加入已知浓度的高聚物溶液10mL,加入后封闭B管,用洗耳球通过A管多次唾弃液至G球,以洗涤A管,并使溶液混合均匀。然后如步骤3,测定该溶液的流出时间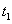 。同法测定加入5,5,10和10mL蒸馏水后各浓度下溶液的流出时间
。同法测定加入5,5,10和10mL蒸馏水后各浓度下溶液的流出时间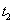 、
、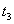 、
、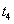 和
和 。
。
实验三 燃烧焓的测定
一.实验目的:
1. 使用弹式量热计测定萘的燃烧焓。
2. 了解量热计的原理和构造,掌握其使用方法。
3. 掌握贝克曼温度计的操作规则和高压钢瓶安全使用常识。
二.实验原理:
在适当的条件下,许多有机物都能迅速而完全地进行氧化反应,这就为准确测定他们的燃烧热创造了有利条件。在实验中用压力为2.5~3MPa的氧气作为氧化剂。用氧弹量热计进行实验时,在量热计与环境没有热交换的情况下,实验时保持水桶中水量一定,可写出如下的热量平衡式:
Qv·W+Qv? ·W? +Cv? △T= 0 (1)
式中:Qv—每克试样的恒容燃烧热,J/g;W—试样的质量g;Qv? —每克点火丝的恒容燃烧热,J/g;W?—点火丝实际燃烧的质量,g;Cv—仪器的恒容热容,J/K,△T—体系的温升,K。
注:△T通过雷诺校正求出。
标准燃烧热是指在标准状态下,1mol物质完全燃烧成同一温度的指定产物的焓变化,以△cHφm表示。在氧弹量热计中可得物质得定容摩尔燃烧热△cUm。如果将气体看成是理想的,且忽略压力对燃烧热的影响,则可由下式将定容燃烧热换算为标准摩尔燃烧热:
Qp,m= △cHφm== △cUm+P△V= △cUm+ △nRT = Qv,m+△nRT(2)
式中,△n—燃烧前后气体的物质的量的变化。
三、仪器和药品:
1.仪器:氧弹量热计;贝克曼温度计;压片机;电子天平;1000mL容量瓶,氧气钢瓶。
2.药品:苯甲酸;萘。
四.实验步骤:
1.在台称上称约0.8 g苯甲酸,在压片机上压片,除去片上粘附的粉末,在分析天平上准确称量。
2.用手拧开氧弹盖,将盖放在专用架上。
3. 剪取10cm左右的点火丝,放在天平上称量后,将点火丝的两端在电极上缠紧,后将点火丝绕成螺旋形,并使之与悬在坩埚上方的药片紧密接触。
4.用万用表检查二电极是否通路,拧紧氧弹。
5. 关好出口,拧下进气管上的螺钉,导气管的另一端与氧气钢瓶上的氧气减压阀连接,打开钢瓶阀门及减压阀缓缓进气,达1.1Mpa,稳定1~2分钟后,关上阀门及减压阀,拧下氧弹上的导气管螺钉,再次检查电极是否通路。
6. 量热计水夹中装入自来水,用量筒量取3升自来水装入干净的铜水桶中,水温较夹套水温低0.5℃左右。确定点火按钮的位置。在两极上接上点火线,装上已调好的贝克曼温度计,盖好盖子,开动搅拌器。
7. 待温度变化基本稳定后,开始读点火前最初阶段的温度,每隔一分钟读一次,可根据情况读4~10次,读数完毕,立即按电钮点火。
8. 点火后每半分钟读一次数,直至读数稳定,稳定后每分钟读一次数,可视情况读4~10次后停止实验。
9.用同样方法在台秤上称取约0.6g萘进行压片,其余操作与前相同。
10.实验完毕,清洗仪器,关闭电源,整理实验台。
实验八二组分合金相图的绘制
一、实验目的:
1.通过实验,用热分析法测绘锡-铋二元合金相图。
2.了解热分析法的测量技术与有关测量温度的方法。
二、实验原理:
绘制相图常用的基本方法,其原理是根据系统在均匀冷却过程中,温度随时间变化情况来判断系统中是否发生了相变化。将金属溶解后,使之均匀冷却,每隔一定时间记录一次温度,表示温度与时间关系的曲线称为步冷曲线。若熔融体系在均匀冷却的过程中无相变,得到的是平滑的冷却线,若在冷却的过程中有相变发生,那么因相变热的释放与散失的热量有所抵偿,步冷曲线将出现转折点或水平线段,转折点所对应的温度即为相变温度。
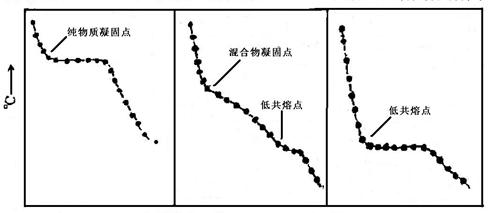
 时间
时间
(a)纯物质(b)混合物(c)低共熔混合物
图1典型步冷曲线
对于简单的低共熔二元合金体系,具有图1所示的三种形状的步冷曲线。由这些步冷曲线即可绘出合金相图。如果用记录仪连续记录体系逐步冷却温度,则记录纸上所得的曲线就是步冷曲线。
用热分析法测绘相图时,被测体系必须时时处于或接近相平衡状态,因此体系的冷却速度必须足够慢才能得到较好的结果。
Sn—Bi合金相图还不属简单低共熔类型,当含Sn 81%以上即出现固熔体。
三、实验仪器和药品:
仪器和材料:金属相图实验炉(图2),微电脑温度控制仪,铂电阻,玻璃试管,坩埚,台天平。
药品:纯锡(CR)、纯铋(CR),石墨。
四、实验步骤:
1.配制样品
用感量为0.1g的托盘天平分别配制含铋量为30%、58%、80%的锡铋混合物各100g,另外称纯铋100g、纯锡100g,分别放入五个样品试管中。
2.通电前准备
① 首先接好炉体电源线、控制器电源、铂电阻插头、信号线插头、接地线。
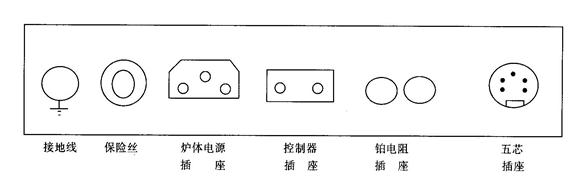 图2金属相图实验炉接线图
图2金属相图实验炉接线图
②将装好药品的样品管插入铂电阻,然后放入炉体。
③设置控制器拨码开关:由于炉丝在断电后热惯性作用,将会使炉温上冲100℃—160℃(冬天低夏天高)。因此设置拨码开关数值应考虑到这一点。例如:要求样品升温为350℃,夏天设置值为170℃。当炉温加热至170℃时加热灯灭,炉丝断电,由于热惯性使温度上冲至350℃后,实验炉自动开始降温。
④将炉体黑色旋钮(电压指示旋钮)反时针旋转到底,处于保温状态。
3.通电工作
①通电升温:接通电源,控制器显示室温,加热灯亮,炉体上电压表指示电压值,炉体开始升温。
②炉体自动断电:当炉内温度(即显示温度)高于设置温度后,加热灯灭,电压表指零,炉内电流切断,停止加热。
③限温功能:为了防止拨码开关值设置过大而损坏铂电极,软件功能使拨码开关百位数不大于2,即温度最高设置值为299℃(万一拨码开关百位数大于2,程序中也认为是2)这样温度上冲后不会超过铂电阻的极限值500℃。
④一次加热功能:由于实验中按先升温后降温的顺序进行,所以软件中采取一定的措施使得温度降到低于拨盘值时仍不加热,只有操作人员按复位键或重新通断一次电源,炉体才重新开始加热至拨码开关值。
⑤中途加热:当炉体升温未达到要求温度时,如果显示温度小于299℃,则可增加拨码开关数值后再按一下复位键,加热继续进行。当显示温度超过299℃时,把黑色旋钮向顺时针旋动(工作人员不能离开),这时炉体继续加热,注意应提前切断炉丝电流(防止热惯性使温度上冲过高),即反时针旋动黑色旋钮至电压指示为零。
⑥保温功能:由于冬季气温较低,为防止温度下降太快,不易发现拐点平台现象,可将黑色旋钮顺时针旋动,使电压表指示20V—40V,使炉体中有少量的保温电流。正常温度下降为一分钟4℃左右。
⑦报时功能:按定时键可选择15—60秒的定时鸣笛,按第一次,显示15秒,第二次显示30秒,依次类推,按复位键可使叫声停止。
4.测步冷曲线
依次测纯铋、含铋30%、58%、80%的铋锡混合物及纯锡等的步冷曲线,方法如下:将装了样品的样品管放入金相相图实验炉,接通电炉电源,样品熔化后,在样品上面覆盖一层石墨粉或松香(防止金属被氧化),用小玻棒将熔融金属搅拌均匀。同时将铂电阻热端插入熔融金属中心距样品管底1cm处。样品温度不宜升得太高,一般在熔化全部金属后,再升高30℃即可停止加热,让样品在样品管内缓缓冷却,同时开动微电脑控制器,冷却过程中每隔一分钟记录一次控温仪上的温度读数,记录冷却曲线。冷却速度不能太快,最好保持降温速度在6—8℃min-1。
实验十二 过氧化氢的催化分解
一、实验目的:
1.用静态法测定H2O2分解反应的速度常数和半衰期。
2.熟悉一级反应特点,了解反应物浓度、温度、催化剂等因素对一级反应速度的影响。
3.掌握量气技术和体积校正,学会用图解计算法求出一级反应的速度常数。
二、实验原理:
1. 凡反应速度只与反应物浓度的一次方成正比的反应,称为一级反应,实验证明H2O2的分解反应如下:

2 H 2O 2→ 2 H 2O + O 2(1)

2. 若该反应属于一级反应,则其速度方程应是:
式中:CH2O2—时间t时的H2O2浓度;k—反应速度常数。
3. 化学反应速度取决于许多因素,如反应物浓度、搅拌速度、反应压力、温度、催化剂等等。某些催化剂可以明显的加速H2O2的分解,它们有Pt、Ag、MnO2、FeCl3、碘化物。本实验用I-(具体用KI)作为催化剂。由于反应在均匀相(溶液)中进行,故称为均相催化反应。
设该反应为一级反应,且按下列式进行:
H2O2+ I-→ H2O + IO-(A)
H2O2+ IO-→ H2O + O2(B)
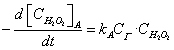 则因
则因
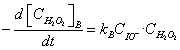 及
及
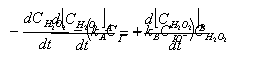
其总反应速度为上两式之和,即:
则kACI -=kBCIO-
亦即反应速度应为:
由于催化剂在反应前后的浓度是不变的,CI-或CIO-就可视为常数,令k=2kACI-= 2kBCIO ?
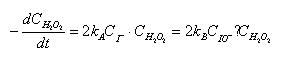

最后得:
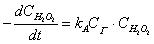 若反应(A)的速度慢于反应(B),则整个反应速度决定于反应(A),因而
若反应(A)的速度慢于反应(B),则整个反应速度决定于反应(A),因而
可假定其速度方程式,即为: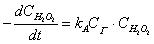

从而亦可简化为:
式(3)表示,H2O2的分解反应为一级反应。
尽管k会因CI?而变,但对H2O2分解来说,则仍是一级反应。
4. 一级反应的积分式为
lnCH2O2= -k t+ lnC0H2O2(4)
上式中C0H2O2是反应开始时H2O2的浓度(摩尔/升)
公式(4)为直线方程,故我们若以lnCH2O2对时间作图而得一直线时,则可验证反应为一级反应。该直线之斜率为-k,截距为lnCH2O2。
5. 由于分解过程中放出的氧气体积与已被分解的H2O2浓度成正比,比例常数为定值,故在相应时间内分解放出氧的体积即可得出时刻t的H202浓度。
令Vf表示H2O2全部分解时产生的O2气体体积。Vt表示在t时刻分解所放出的O2气体体积,则显然
C0H2O2∞VfCH2O2∞(Vf-Vt)
代入(4)式,得:
ln(Vf-Vt)= -kt+ lnVf(5)
Vf可由H2O2的体积及浓度算出。标定CH2O2之方法如下:按其分解反应的化学方程式可知一摩尔H2O2放出1/2摩尔O2,在酸性溶液中以高锰酸钾标准溶液滴定H2O2,求出CH2O2,就可由下式算出Vf:




PO2—氧分压即大气压减去实验温度下水的饱和蒸汽压。
T—即量气管的温度(K)
Vf亦可采用下面两种方法来求得:
(a)外推法:以1/t为横坐标,对Vt作图,将直线外推至1/t=0,其截距即Vf。
(b)加热法:在测定若干个Vt数据后,将H2O2加热至50—60℃约15分钟,可认为H2O2已基本分解完毕,待溶液冷却到实验温度时读出量气管读数即为Vf,同学们可自择二者之一,与滴定结果作对照。

6. 当 CH2O2=1/2 C 0H2O2时, t可用 t 1/2表示,称为反应半衰期,代入式(4)得

上式表示:当温度一定时,一级反应的半衰期与反应速度常数成反比,与反应初浓度无关。
三、仪器和药品:
1.仪器:H2O2分解速率测定装置;滴定管;秒表;移液管(5、10、20ml);锥形瓶(150、250ml)。
2.药品:H2O2溶液(质量分数为2%);KI溶液(0.1mol/L);H2SO4溶液(3.0mol/L) KMnO4标准溶液(0.05mol/L)。
四、实验步骤:
1. 在图20-1所示装置中,将水准球内加水,使水位与量气管满刻度处齐平。(打开三通活塞,使大气与量气管相通)。与此同时调节恒温槽温度。
2. 调节恒温槽温度:在1000ml烧杯中加入250ml水,水温控制在25℃左右并使在实验中能够基本恒定。烧杯放在搅拌器座上。夹好测温用温度计。
3. 用移液管移取己恒温至25℃的10ml水放入洁净干燥的锥形瓶中,再移取10ml已恒温到同样温度的H2O2注入到锥形瓶中。将已准确称量好的KI试剂 0.160克小心放在液面上勿使KI与液面接触,最后塞好橡皮塞,进行试漏。
4. 把锥形瓶小心的放入恒温槽,将三通活塞 4 旋与大气、量气管都相通,举高水准球使量气管充满水,然后再旋活塞 4 切断与大气的通路,但仍使系统内部联通,将水准瓶放到最低位置,若量气管中水位在2分钟内保持不变,说明系统不漏气,可以进行分解反应。
5. 旋动三通活塞与大气相通,使水面恰在量气管“0”刻度处,然后切断大气通路,打开搅拌器开关,同时记下时间,此时KI容器倾倒,KI溶于H2O2溶液中,分解反应开始,当O2开始释放出后应随时保持水准瓶和量气管液面在一水平线上。定时(每2.0分钟)读出量气管中气体体积(或定体积地读出反应时间,每5mL读一次)。直到量气管中O2体积超过50mL。
6. 选用加热求Vf时,接通电源使水浴升温,温度可达到50℃,一刻钟后从水浴中移出反应瓶,冷却至室温后读出量气管读数V和T(k),记下当时的大气压力,计算出Vf。
7. 最后标定所用H2O2的原始浓度:用移液管取2ml H2O2放在锥形瓶中,加入10ml 3mol/L H2SO4酸化后用已知浓度的KMnO4标准溶液滴定至淡红色为止。
8. 根据公式7计算出H2O2的浓度。
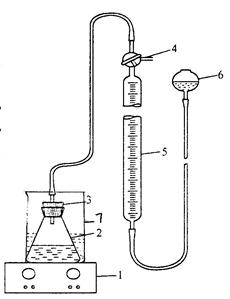
图19-1 H2O2分解速率测定装置 (在注入溶液前先将搅拌棒放入锥形瓶中)。
1-电磁搅拌器;2-锥形瓶;3-橡皮塞;4-三通活塞;5-量气管;6-水准瓶

