物质结构 元素周期律单元知识总结
一、原子结构
1.构成原子的粒子及其关系
(1)原子的构成

(2)各粒子间关系
原子中:原子序数=核电荷数=质子数=核外电子数
阳离子中:质子数=核外电子数+电荷数
阴离子中:质子数=核外电子数一电荷数
原子、离子中:质量数(A)=质子数(Z)+中子数(N)
(3)各种粒子决定的属性
元素的种类由质子数决定。
原子种类由质子数和中子数决定。
核素的质量数或核素的相对原子质量由质子数和中子数决定。
元素中是否有同位素由中子数决定。
质子数与核外电子数决定是原子还是离子。
原子半径由电子层数、最外层电子数和质子数决定。
元素的性质主要由原子半径和最外层电子数决定。
2.原子、离子半径的比较
(1)原子的半径大于相应阳离子的半径。
(2)原子的半径小于相应阴离子的半径。
(3)同种元素不同价态的离子,价态越高,离子半径越小。
(4)电子层数相同的原子,原子序数越大,原子半径越小(稀有气体元素除外)。
(5)最外层电子数相同的同族元素的原子,电子层数越多原子半径越大;其同价态的离子半径也如此。
(6)电子层结构相同的阴、阳离子,核电荷数越多,离子半径越小。
3.核素、同位素
(1)核素:具有一定数目的质子和一定数目的中子的一种原子。
(2)同位素:同一元素的不同核素之间的互称。
(3)区别与联系:不同的核素不一定是同位素;同位素一定是不同的核素。
二、元素周期律和元素周期表
1.元素周期律及其应用
(1)发生周期性变化的性质
原子半径、化合价、金属性和非金属性、气态氢化物的稳定性、最高价氧化物对应水化物的酸性或碱性。
(2)元素周期律的实质
元素性质随着原子序数递增呈现出周期性变化,是元素的原子核外电子排布周期性变化的必然结果。也就是说,原子结构上的周期性变化必然引起元素性质上的周期性变化,充分体现了结构决定性质的规律。具体关系如下:

2.比较金属性、非金属性强弱的依据
(1)金属性强弱的依据
单质跟水或酸置换出氢的难易程度(或反应的剧烈程度)。反应越易,说明其金属性就越强。
最高价氧化物对应水化物的碱性强弱。碱性越强,说明其金属性也就越强,反之则弱。
金属间的置换反应。依据氧化还原反应的规律,金属甲能从金属乙的盐溶液中置换出乙,说明甲的金属性比乙强。
金属阳离子氧化性的强弱。阳离子的氧化性越强,对应金属的金属性就越弱。
(2)非金属性强弱的依据
单质跟氢气化合的难易程度、条件及生成氢化物的稳定性。越易与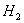 反应,生成的氢化物也就越稳定,氢化物的还原性也就越弱,说明其非金属性也就越强。
反应,生成的氢化物也就越稳定,氢化物的还原性也就越弱,说明其非金属性也就越强。
最高价氧化物对应水化物酸性的强弱。酸性越强,说明其非金属性越强。
非金属单质问的置换反应。非金属甲把非金属乙对应的阴离子从其盐溶液中置换出来,说明甲的非金属性比乙强。
非金属元素的原子对应阴离子的还原性。还原性越强,元素的非金属性就越弱。
3.常见元素化合价的一些规律
(1)金属元素无负价。金属单质只有还原性。
(2)氟、氧一般无正价。
(3)若元素有最高正价和最低负价,元素的最高正价数等于最外层电子数;元素的最低负价与最高正价的关系为:最高正价+|最低负价|=8。
(4)除某些元素外(如N元素),最外层电子数为奇数的元素,其化合价也常呈奇数价,最外层电子数为偶数的元素,其化合价也常呈偶数价,即价奇序奇,价偶序偶。
4.原子结构、元素性质及元素在周期表中位置的关系

原子半径越大,最外层电子数越少,失电子越易,还原性越强,金属性越强。
原子半径越小,最外层电子数越多,得电子越易,氧化性越强,非金属性越强。
在周期表中,左下方元素的金属性大于右上方元素;左下方元素的非金属性小于右上方元素。
5.解答元素推断题的一些规律和方法
元素的推断多为文字叙述题。考查该知识点的题型主要有选择题、填空题、推断题等,涉及知识面广,常给出如下条件:结构特点,性质特点,定量计算。常需运用相关的基础知识去解决问题。
(1)根据原子结构与元素在周期表中的位置关系的规律
电子层数=周期数,主族序数=最外层电子数
原子序数=质子数,主族序数=最高正价数
负价的绝对值=8-主族序数
(2)根据原子序数推断元素在周期表中的位置。
记住稀有气体元素的原子序数:2、10、18、36、54、86。用原子序数减去比它小而相近的稀有气体元素的原子序数,即得该元素所在的纵行数。再运用纵行数与族序数的关系确定元素所在的族;这种元素的周期数比相应的稀有气体元素的周期数大1。
(3)根据位置上的特殊性确定元素在周期表中的位置。
主族序数等于周期数的短周期元素:H、Be、Al。
主族序数等于周期数2倍的元素:C、S。
最高正价与最低负价代数和为零的短周期元素:C、Si
短周期中最高正价是最低负价绝对值3倍的元素:S。
三、化学键
1.化学键
(1)化学键的定义:相邻的两个或多个原子或离子间的强烈的相互作用。
(2)化学键的存在:化学键只存在于分子内部或晶体中的相邻原子间以及阴、阳离子间。对由共价键形成的分子来说就是分子内的相邻的两个或多个原子间的相互作用;对由离子形成的物质来说,就是阴、阳离子间的静电作用。这些作用是物质能够存在的根本原因。
(3)离子键、共价键的比较

(4)物质中的化学键的判断规律
离子化合物中一定有离子键,可能有共价键。
共价化合物、非金属单质中只有共价键。
稀有气体元素的单质中无化学键。
2.书写电子式注意的几个问题
(1)用电子式表示离子化合物的形成过程时要注意的几点:
①左边写出形成离子化合物所需原子的电子式,右边写出生成的离子化合物的电子式,中间用“→”连接。
②用电子式表示离子化合物的结构时,简单的阳离子一般用离子符号表示,而阴离子和复杂的阳离子则不同,在元素符号周围一般用小黑点(或×)表示最外层电子数,外面再加[],并在[]右上方标出所带电荷。
③构成离子化合物的每个离子、原子都要单独写,不可合并;并标出电子转移方向
(2)用电子式表示共价化合物或非金属单质的形成过程时要注意的几点:
①左边写出形成共价化合物所需原子的电子式且相同的原子可以合并,右边写出共价化合物的电子式,中间用“→”连接(非金属单质也相同),。
②不同元素的原子形成分子时共用电子对的数目不同,原子的最外层有几个孤对电子,一般就要共用几对电子。
③共价化合物中没有离子,表示电子式时不使用括号,也不标电荷数。
化学反应与能量单元知识总结
一、化学反应中的热量变化
1、放热反应:化学上有热量放出的化学反应 反应物的总能量>生成物的总能量
断开化学键所吸收的能量小于形成化学键所放出的能量
2、吸热反应:化学上吸收热量的化学反应 生成物的总能量>反应物的总能量
断开化学键所吸收的能量大于形成化学键所放出的能量
常见的放热反应:燃烧、酸碱中和反应、金属与酸的反应、氧化钙与水
常见的放热反应:通常需要高温或者加热的反应(C+CO2)、氢氧化钙与氯化铵晶体反应
燃烧放出的热量的大小等于断裂开反应物分子中化学键吸收的总能量与形成生成物分子中化学键放出的总能量之差。
二、原电池:将化学能转化为电能的装置
本 质:氧化还原反应
原 理:较活泼的金属发生氧化反应,电子从较活泼的金属(负极)流向较不活泼的金属或非金属导体(正极)
需掌握四种电池的电极反应
1、锌--铜—硫酸原电池 2、锌--铜—硫酸铜原电池
3、铁—石墨—氯化钠原电池 4、氢氧燃料电池(电解质分别为硫酸和氢氧化钠两种情况)
三、化学反应速率
1. 定义:化学反应速率是用来衡量化学反应进行快慢的物理量, 常用单位时间内反应物浓度的减小或生成物浓度的增加来表示,其数学表达式可表示为 单位moL/(L·s)
单位moL/(L·s)
注意:各物质表示的速率比等于该反应方程式中相应的计量系数比
2.影响化学反应速率的因素
(1)内因:反应物的性质(主要)
(2)外因 其他条件不变时
①温度:温度越高反应速率越快)
②压强:对于有气体参加的反应,增加压强若体系的体积变小则化学反应速率越快,若体系
的体积不变则化学反应的速率不变
③浓度:浓度越大反应速率越快
④催化剂:使用正催化剂化学反应速率增大
其他:反应接触面积的大小、固体反应物的颗粒大小、光照、超声波、电磁波、溶剂等因素对反应速率也有影响
四、化学反应限度
1、 可逆反应:在同一条件下,既可以向正反应方向进行,同时又可以向逆反应方向进行。可逆反应有一定限度,反应物不可能完全转化为生成物。
2、 化学平衡状态:在一定条件下的可逆反应里,当正反应速率等于逆反应速率,体系中各组分的量不再变化的状态
3、化学平衡的特征:
逆:可逆反应
动:动态平衡,反应一直进行 V正≠0, V逆≠0,
等:V正=V逆
定:各组分的物理量保持不变(不是相等,也不是某种比例)
变;条件改变,平衡发生移动
4、判断平衡的方法:
① V正=V逆,同一种物质正逆反应速率相等,不同物质正逆反应速率比为化学计量数之比(必须一正一逆)
② 各组分的物理量保持不变(不是相等,也不是某种比例)。注意:若体系的物理量保持不变,不一定平衡,需具体分析.
第二篇:高一化学必修1上学期期中知识点总结
三、离子检验
离子 所加试剂 现象 离子方程式
Cl- AgNO3、稀HNO3 产生白色沉淀 Cl-+Ag+=AgCl↓
SO42- 稀HCl、BaCl2 白色沉淀 SO42-+Ba2+=BaSO4↓
四.除杂
注意事项:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去。
物质的量及其单位??摩尔
1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数:把6.02 ×1023mol-1叫作阿伏加德罗常数。
4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA
5.摩尔质量(M)(1) 定义:单位物质的量的物质所具有的质量叫摩尔质量.
(2)单位:g/mol
(3) 数值:等于该粒子的相对原子质量或相对分子质量.
6.物质的量=物质的质量/摩尔质量 ( n = m/M )
气体摩尔体积
1.气体摩尔体积(Vm)
(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.
(2)单位:L/mol
2.物质的量=气体的体积/气体摩尔体积n=V/Vm
3.标准状况下, Vm = 22.4 L/mol
物质的量浓度
1.物质的量浓度.
(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:mol/L
(3)物质的量浓度 = 溶质的物质的量/溶液的体积 CB = nB/V
2.一定物质的量浓度的配制
(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.
(2)主要操作
a.检验是否漏水.b.配制溶液
1计算.2称量.3溶解.4冷却5转移. 6洗涤. 7定容. 8摇匀9装瓶贴签. 注意事项:
A 选用与欲配制溶液体积最相近的容量瓶.如需要480mL,则需要配500mL.
B 使用前必须检查是否漏水.
C 不能在容量瓶内直接溶解.
D 溶解完的溶液等冷却至室温时再转移.
E 定容时,当液面离刻度线1?2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.
3.溶液稀释:C(浓溶液)?V(浓溶液) =C(稀溶液)?V(稀溶液)
物质的分类
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
溶液、胶体、浊液三种分散系的比较
分散质粒子大小 外观特征 能否通过滤纸 有无丁达尔效应 实例 溶液 小于1 nm 均匀、透明、稳定 能 无 NaCl、蔗糖溶液 胶体 在1—100之间 均匀,有的透明,较稳定 能 有 淀粉溶液,Fe(OH)3 浊液 大于100 nm 不均匀,不透明,不稳定 不能 没有 泥水 离子反应
(1)、电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。 酸、碱、盐都是电解质。
在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。
注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。③能导电的物质并不全部是电解质:如铜、铝、石墨、氯化钠溶液等。④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。
(2)离子方程式:用实际参加反应的离子符号来表示反应的式子。它不仅表示一个具体的化学反应,而且表示同一类型的离子反应。
复分解反应这类离子反应发生的条件是:生成沉淀、气体或弱电解质。 书写方法:
写:写出反应的化学方程式
拆:把易溶于水、易电离的物质拆写成离子形式
删:将不参加反应的离子从方程式两端删去
查:查方程式两端原子个数和电荷数是否相等
(3)离子共存问题
所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
A、结合生成难溶物质的离子不能大量共存:如Ba2+和SO42-、Ag+和Cl-、Ca2+和CO32-、Mg2+和OH-等
B、结合生成气体或易挥发性物质的离子不能大量共存:如H+和C O 32-,HCO3-,SO32-,OH-和NH4+等
C、结合生成难电离物质(水)的离子不能大量共存:如H+和OH-、CH3COO-,OH-和HCO3-等。
D、发生氧化还原反应、水解反应的离子不能大量共存(待学)
注意:题干中的条件:如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-等离子,酸性(或碱性)则应考虑所给离子组外,还有大量的H+(或OH-)。(4)离子方程式正误判断(六看)
一、看反应是否符合事实:主要看反应能否进行或反应产物是否正确
二、看能否写出离子方程式:纯固体之间的反应不能写离子方程式
三、看化学用语是否正确:化学式、离子符号、沉淀、气体符号、等号等的书写是否符合事实
四、看离子配比是否正确
五、看原子个数、电荷数是否守恒
六、看与量有关的反应表达式是否正确(过量、适量)
物质的化学变化
1、物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。
(1)根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:
A、化合反应(A+B=AB)
B、分解反应(AB=A+B)
C、置换反应(A+BC=AC+B)
D、复分解反应(AB+CD=AD+CB)
(2)根据反应中是否有离子参加可将反应分为:
A、离子反应:有离子参加的一类反应。主要包括复分解反应和有离子参加的氧化还原反应。
B、分子反应(非离子反应)
(3)根据反应中是否有电子转移可将反应分为:
A、氧化还原反应:反应中有电子转移(得失或偏移)的反应
实质:有电子转移(得失或偏移)
特征:反应前后元素的化合价有变化
B、非氧化还原反应
3、氧化还原反应中概念及其相互关系如下:
失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性) 得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性)
五、Na2CO3和NaHCO3比较
碳酸钠 碳酸氢钠
俗名 纯碱或苏打 小苏打
色态 白色晶体 细小白色晶体
水溶性 易溶于水,溶液呈碱性使酚酞变红 易溶于水(但比Na2CO3溶解度小)溶液呈碱性(酚酞变浅红)
热稳定性 较稳定,受热难分解 受热易分解
2NaHCO3 Na2CO3+CO2↑+H2O
与酸反应 CO32—+H+ H CO3—
H CO3—+H+ CO2↑+H2O
H CO3—+H+ CO2↑+H2O
氯气
(1)氯元素:在自然界中以化合态存在。
(2)Cl2的物理性质:黄绿色气体,有刺激性气味、可溶于水(1:2)、易液化 (液氯)
闻法:用手在瓶口轻轻扇动,使少量氯气进入鼻孔。
(3)Cl2的化学性质:很活泼,有毒,有氧化性, 能与大多数金属化合生成金属氯化物(盐)。也能与非金属反应:
2Na+Cl2 ===(点燃) 2NaCl
2Fe+3Cl2===(点燃) 2FeCl3
Cu+Cl2===(点燃) CuCl2
Cl2+H2 ===(点燃) 2HCl 现象:安静地燃烧,发出苍白色火焰,集气瓶口有白雾生成。
燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。燃烧的本质是剧烈的氧化还原反应,所有发光放热的剧烈化学反应都称为燃烧。
(4)Cl2的用途:
①自来水杀菌消毒Cl2+H2O == HCl+HClO
2HClO ===(光照) 2HCl+O2 ↑
1体积的水溶解2体积的氯气形成的溶液为氯水,为浅黄绿色。其中次氯酸HClO有强氧化性和漂泊性,起主要的消毒漂白作用。次氯酸有弱酸性,不稳定,光照或加热分解,因此久置氯水会失效,变为稀盐酸。
②制漂白液、漂白粉和漂粉精
制漂白液 Cl2+2NaOH=NaCl+NaClO+H2O ,其有效成分NaClO 制漂白粉 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
次氯酸盐比HClO稳定得多,可长期存放
(5)氯离子的检验 :
使用硝酸银溶液,并用稀硝酸排除干扰离子(CO32-、SO32-)
Cl-+Ag+ == AgCl ↓

