高中化学实验四 碱金属单质及化合物的性质
【实验目的】
1、认识金属钠的物理性质,探究钠与氧气、水反应。
2、了解过氧化钠的物理性质,探究过氧化钠与水、二氧化碳的反应。
3、实验碳酸钠与碳酸氢钠的重要性质。
4、掌握焰色反应的实验操作。
【实验器具】
仪器:玻璃片、小刀、滤纸、镊子、坩埚盖、大烧杯、酒精灯、铁架台(带铁夹)、试管、火柴、铂丝(或光洁无锈铁丝)、酒精灯、蓝色钴玻璃(检验钾时用)
试剂:金属钠、过氧化钠、水、酚酞溶液、碳酸钠、碳酸氢钠、稀盐酸、氯化钠溶液、氯化钾溶液、胆矾粉末。
【实验探究过程与结论】
一、探究钠与过氧化钠的性质

二、探究碳酸钠和碳酸氢钠的性质
三、焰色反应
1、实验操作
(1)将铂丝用稀盐酸清洗干净,再在无色火焰上灼烧至无色;
(2)蘸取试样(固体也可以直接蘸取)在无色火焰上灼烧,观察火焰颜色,从而判断试样中所含元素种类。
(3)将铂丝再用稀盐酸清洗干净,即可继续做新的实验。
注意:若检验钾元素要透过蓝色钴玻璃观察。因为多数情况下钾离子溶液中常含有钠离子,而钠元素的焰色反应为很浓的黄色,掩盖了钾元素很浅的紫色,导致无法判断)。
2、实验结果
钠元素的焰色为,钾元素的焰色为,铜元素的焰色为。
【实验练习】
1.钠着火时,采用哪种来灭火方式最好…………………………………………………( )
A、水 B、煤油 C、泡沫灭火器 D、砂子
2.少量NaOH最好贮存在…………………………………………………………………( )
A、敞口塑料瓶中 B、玻璃塞的棕色瓶中
C、橡胶塞的广口瓶中 D、铁制容器中
3.下列关系正确的是………………………………………………………………………( )
A、还原性:Na>K B、离子半径:Na+>K+
C、热稳定性:Na2CO3>NaHCO3D、熔点:Na<K
4.下列叙述中不正确的是…………………………………………………………………( )
A、钠在反应TiCl4+4Na=Ti+4NaCl中作还原剂
B、NaOH应密封保存,以防分解变质
C、金属锂不能保存在煤油中
D、盛放KOH溶液的试剂瓶不能用玻璃塞
5.将6g钠和3.2g硫粉迅速混合,放在石棉网上加热,反应后所得固体物质的成分是( )
A、Na2O和S B、Na2O和Na2O2C、Na2O和Na2S D、Na2O2和Na2S
6.在实验室里做钠跟水反应的实验时,用到的仪器是…………………………………( )
a.试管夹,b.镊子,c.小刀,d.冷凝管,e.滤纸,f.研钵,g.烧杯,h.坩埚,
i.石棉网,j.玻璃片,k.药匙,l.燃烧匙
A、abdi B、cefk C、fghl D、bcegj
7.从理论上讲,Li是很活泼的金属,与水反应应当很剧烈。但事实上反应却是开始较快,一会儿就迅速缓慢起来。其原因主要是…………………………………………………( )
A、Li的密度很小,浮在水面上 B、生成物LiOH溶解度较小,附着在Li表面
C、反应开始放热而使速率变慢 D、反应产物对此反应有催化作用
8.在一定温度下,向饱和烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温,下列说法正确的是…………………………………………………………………………( )
A、溶液中Na+浓度增大,有O2放出 B、溶液pH值不变,有H2放出
C、溶液中Na+数目减少,有O2放出 D、溶液pH值增大,有O2放出
9.下列对进行焰色反应的实验操作注意事项的说明,正确的是………………………( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先灼烧铂丝到火焰无色时,再蘸被检验物质
③每次实验后都要将铂丝蘸浓盐酸后灼烧至火焰无色为止
④实验时最好选择本身颜色较强的火焰
⑤没有铂丝可用无锈铁丝代替
A、仅③不正确 B、仅④不正确 C、④和⑤不正确 D、全部正确
10.Na2CO3是一种很重要的化学物质,某中学某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程:
将50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
①将50mL NaOH溶液均分为两份,各25mL;
②用第一份25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
③再小心煮沸溶液1~2分钟;
④在得到的溶液中加入另一份(25mL)NaOH溶液,使溶液充分混合。
问题:
I、在②中,刚通入CO2时发生的反应是;而后又发生反应;将以上两个反应分别改写成离子反应是、。
③中煮沸溶液的目的是。
④中混合另一份NaOH溶液后发生的反应是,改写为离子方程式是。
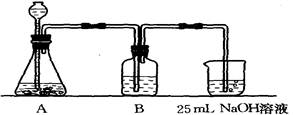 II、按该同学的设计,第②步实验装置如下:
II、按该同学的设计,第②步实验装置如下:
(1)装置A使用的试剂是(固体)和溶液;
(2)装置B使用的试剂最好是(选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是,不选择其它三种试剂的原因是(简要文字说明);
(3)写出B中可能发生的离子方程式,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有。
(4)有人认为实验步骤③、④顺序对调,即先混合、再煮沸更为合理,你认为对吗?。为什么?。
第二篇:铬,锰及其化合物的相关性质的实验报告
铬,锰及其化合物的相关性质
1.了解铬和锰的各种常见化合物的生成和性质。
2.掌握铬和锰各种氧化态之间的转化条件。
3.了解铬和锰化合物的氧化还原性及介质对氧化还原性产物的影响。
1.铬
在酸性条件下,用锌还原Cr3+或Cr2O72-,均可得到天蓝色的Cr2+
2Cr3++Zn=2Cr2++Zn2+
Cr2O72-+4Zn+14H+=2Cr2++4Zn2++7H2O
灰绿色的Cr(OH)3呈两性:
Cr(OH)3+3H+=Cr3++3H2O
Cr(OH)3+OH-=[Cr(OH)4]-(亮绿色)
向含有Cr3+的溶液中加入Na2S并不生成Cr2S3,因为Cr2S3在水中完全水解:
2Cr3++3S2-+6H2O=2Cr(OH)3+3H2S
在碱性溶液中,[Cr(OH)4]-具有较强的还原性,可被H2O2氧化为CrO42-:
2[Cr(OH)4]-+3H2O2+2OH-=2CrO42-+8H2O
但在酸性溶液中,Cr3+的还原性较弱,只有象K2S2O8或KMnO4等强氧化剂才能将Cr3+氧化为Cr2O72-:
2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
在酸性溶液中,Cr2O72-是强氧化剂,例如:
K2Cr2O7+14HCl(浓)=2CrCl3+3Cl2+2KCl+7H2O
重铬酸盐的溶解度较铬酸盐的溶解度大,因此,向重铬酸盐溶液中加Ag+、Pb+、Ba2+等离子时,通常生成铬酸盐沉淀,例如:
Cr2O72-+4Ag++H2O=2Ag2CrO4(砖红色)+2H+
Cr2O72-+2Ba2++H2O=2BaCrO4(黄色)+2H+
在酸性溶液中,Cr2O72-与H2O2能生成深蓝色的加合物CrO5,但它不稳定,会很快分解为Cr3+和O2。若被萃取到乙醚或戊醇中则稳定得多。主要反应为:
Cr2O72-+4H2O2+2H+=2CrO(O2)2(深蓝)+5H2O
CrO(O2)2+(C2H5)2O=CrO(O2)2(C2H5)2O(深蓝)
4CrO(O2)2+12H+=4Cr3++7O2+6H2O
此反应用来鉴定Cr(Ⅵ)或Cr(Ⅲ)。
2.锰
Mn(OH)2易被氧化
Mn2++2OH-=Mn(OH)2(s)(白色)
2Mn(OH)2+O2=2MnO(OH)2(s)(棕色)
在浓硫酸中,MnSO4与KMnO4反应可生成深红色的Mn3+(实际是硫酸根的配合物):
MnO4-+4Mn2++8H+=5Mn3++4H2O
Mn3+可存在于浓硫酸中,若酸度降低,则Mn3+歧化为Mn2+和MnO2:
2Mn3++2H2O=Mn2++MnO2(s)+4H+
在中性或近中性的溶液中,MnO4-与Mn2+反应生成MnO2:
2MnO4-+3Mn2++2H2O=5MnO2(s)+4H+
在酸性介质中,MnO2是较强的氧化剂,本身被还原为Mn2+:
2MnO2+2H2SO4(浓) 2MnSO4+O2+2H2O
MnO2+4HCl(浓)MnCl2+Cl2+2H2O
后一反应用于实验室中制取少量氯气。
在强碱性溶液中,MnO4-能发生下列反应,生成浅蓝色的不稳定的MnO3-,并放出氧气:
2MnO4-=2MnO3-+O2
MnO3-进一步歧化反应:
2MnO3-=MnO42-+MnO2
在强碱条件下,强氧化剂能把MnO2氧化成绿色的MnO42-
2MnO4-+MnO2+4OH-=3MnO42-+2H2O
MnO42-只在强碱性(pH>13.5)溶液中才能稳定存在,在中性或酸性介质中,MnO42-发生歧化反应:
3MnO42-+4H+=2MnO4-+MnO2+2H2O
在有硝酸存在下,Mn2+可被NaBiO3或PbO2氧化成MnO4-,例如:
5NaBiO3+2Mn2++14H+=2MnO4-+5Bi3++5Na+7H2O
1.铬的化合物的性质
(1)Cr2+的生成
在1mLCrCl3(0.1mol·L-1)溶液中加入1mLHCl(6mol·L-1)溶液,再加少量锌粉,微热至有大量气体逸出,观察溶液的颜色由暗绿变为天蓝色。用滴管将上部清液转移到另一支试管中,在其中加入数滴浓HNO3,观察溶液的颜色有何变化?写出反应方程式。
(2)氢氧化铬的生成和酸碱性
用CrCl3(0.1mol·L-1)溶液和NaOH(2mol·L-1)溶液生成Cr(OH)3,检验它的酸碱性。
(3)Cr(Ⅲ)的还原性
a.在CrCl3(0.1mol·L-1)溶液中加入过量的NaOH(2mol·L-1)溶液使呈亮绿色,再加入H2O2(3%)溶液,微热,观察溶液颜色的变化,写出反应方程式。
b.在Cr2(SO4)3(0.1mol·L-1)溶液中加少量的K2S2O8(s),酸化,加热,观察溶液颜色的变化,写出反应方程式。
(4)Cr3+在Na2S溶液中的完全水解
在Cr2(SO4)3(0.1mol·L-1)溶液中加Na2S(0.1mol·L-1)溶液有何现象(可微热)?怎样证明有H2S逸出?写出反应方程式。
(5)CrO42-和Cr2O72-的相互转化
a.在K2CrO4(0.1mol·L-1)溶液中逐滴加入H2SO4(2mol·L-1)溶液,然后逐滴加入NaOH(2mol·L-1),观察溶液颜色的变化。
b.在两支试管中分别加入几滴K2CrO4(0.1mol·L-1)溶液和几滴K2Cr2O7(0.1mol·L-1)溶液,然后分别滴入Pb(NO3)2(0.1mol·L-1)溶液,比较两试管中生成沉淀的颜色。解释现象,写出反应方程式。
c.用AgNO3(0.1mol·L-1)溶液代替Pb(NO3)2溶液,重复1(5)b实验。
(6)Cr(Ⅵ)的氧化性
a.在K2Cr2O7(0.1mol·L-1)溶液中滴加H2S溶液(饱和),有何现象?写出反应方程式。
b.取少量K2Cr2O7(s),加入10滴浓HCl,加热,检查逸出的气体并观察溶液颜色的变化。写出反应方程式。
(7)Cr3+的鉴定
取5滴含有Cr3+的溶液,加入过量的NaOH(6mol·L-1)溶液,使溶液呈亮绿色,然后滴加H2O2(3%)溶液,微热至溶液呈黄色,待试管冷却后,再补加几滴H2O2和0.5mL戊醇(或乙醚),慢慢滴入HNO3(6mol·L-1)溶液,摇荡试管,戊醇层中出现深蓝色,表示有Cr3+存在。写出各步反应方程式。
2.锰的化合物的性质
(1)Mn(OH)2的生成和性质
在3支试管中各加入0.5mL的MnSO4(0.1mol·L-1)溶液,再分别加入NaOH(2mol·L-1)溶液至有白色沉淀生成;在两支试管中迅速检查Mn(OH)2的酸碱性;另一支试管在空气中振荡,观察沉淀颜色的变化。解释现象,写出反应方程式。
(2)MnS的生成和性质
在MnSO4(0.1mol·L-1)溶液中滴加H2S溶液(饱和),有无沉淀生成?再向试管中加NH3·H2O(2mol·L-1)溶液,摇荡试管,有无沉淀生成?
(3)Mn3+的生成和性质
取5滴MnSO4(0.5mol·L-1)溶液加两滴浓H2SO4,用冷水冷却试管,然后加3~5滴KMnO4(0.01mol·L-1)溶液,有何现象?将所得的溶液用Na2CO3(1mol·L-1)中和,使pH值升高,则Mn3+歧化为Mn2+和MnO2。
(4)MnO2的生成和性质
a.将KMnO4(0.01mol·L-1)溶液和MnSO4(0.5mol·L-1)溶液混合后,是否有MnO2沉淀生成?
b.用MnO2和浓HCl制备氯气,(见实验六中四.2(1)b)
(5)MnO3-的生成和性质
取1mLNaOH(40%)溶液于试管中,加2-3滴KMnO4(0.01mol·L-1)溶液,摇荡试管,观察溶液颜色变化,再滴加H2SO4(1 mol·L-1)溶液,又有何现象发生?
(6)MnO42-的生成何性质
在2mLKMnO4(0.01mol·L-1)溶液中加入1mLNaOH(40%)溶液,再加少量的MnO2固体,加热,搅拌,沉降片刻,观察上层清液的颜色。取清液于另一支试管中,用稀H2SO4酸化后有何现象?为什么?
(7)溶液的酸碱性对MnO4-还原产物的影响
在三支试管中分别加入5滴KMnO4(0.01mol? L-1)溶液,再分别加入5滴H2SO4(2 mol·L-1)溶液、NaOH(6mol·L-1)溶液和H2O,然后各加入几滴Na2SO3(0.1mol·L-1)溶液。观察各试管中发生的变化,写出有关反应的方程式。
(8)Mn2+的鉴定
取两滴MnSO4(0.1mol·L-1)溶液和数滴HNO3(6mol·L-1)溶液,加少量的NaBiO3(s),摇荡试管,静置沉降,上层清液呈紫红色,表示有Mn2+存在。
(9)Mn2+和Cr3+的分离与鉴定
某溶液中含有Mn2+和Cr3+,试分离和鉴定之,并写出分离步骤和有关反应方程式。
*废液和固体废弃物倒入指定容器中。

